| Serpin family A member 1 |
|---|
|
| Identifiers |
|---|
| Aliases |
protease inhibitor 1 (anti-elastase)alpha-1-antitrypsinepididymis secretory sperm binding proteinalpha-1 antitrypsinalpha-1 protease inhibitoralpha-1-antiproteinaseserine (or cysteine) proteinase inhibitorclade Amember 1serpin peptidase inhibitor clade A (alpha-1antiproteinaseantitrypsin) member 1serpin peptidase inhibitorclade A (alpha-1 antiproteinaseantitrypsin)member 1serpin peptidase inhibitor clade A member 1alpha-1-antitrypsin short transcript variant 1C5alpha-1-antitrypsin nullalpha-1-antitrypsinalpha-1-antitrypsin short transcript variant 1C4serpin A1SERPINA1alfa-1-antitrypsin |
| External IDs |
GeneCards: [1] |
|
| Orthologs |
|---|
| Species |
Human |
Mouse |
| Entrez |
|
|
| Ensembl |
|
|
| UniProt |
|
|
| RefSeq (mRNA) |
|
|
| RefSeq (protein) |
|
|
| Location (UCSC) |
n/a |
n/a |
|
PubMed search |
n/a |
n/a |
| Wikidata |
|
แอลฟาวัน-แอนติทริปซิน (อังกฤษ: Alpha-1 antitrypsin หรือ α1-antitrypsin; สัญลักษณ์: A1AT, α1AT, A1A , AAT) เป็นโปรตีนในกลุ่มเซอร์ปิน ถูกถอดรหัสได้จากยีน SERPINA1 บนโครโมโซมคู่ที่ 14 ออกฤทธิ์เป็นสารต้านโปรตีเอส จึงเป็นที่รู้จักกันในอีกชื่อ คือ alpha1–proteinase inhibitor (A1PI) หรือ alpha1-antiproteinase (A1AP) เนื่องจากสามารถออกฤทธิ์ต้านโปรตีเอสได้หลายชนิด ไม่เฉพาะแค่ทริปซิน ในเอกสารชีวการแพทย์สมัยก่อน บางครั้งอาจเรียกโปรตีนชนิดนี้ว่า serum trypsin inhibitor (STI, สารต้านทริปซินในเลือด) เนื่องจากในการศึกษาช่วงแรกนั้น โปรตีนชนิดนี้มีความคุณสมบัติเด่นในการเป็นตัวยับยั้งทริปซิน ด้วยการที่ออกฤทธิ์เป็นสารต้านเอนไซม์ A1AT จึงช่วยปกป้องเนื้อเยื่อต่างๆ จากเอนไซม์หลายชนิดที่ถูกหลั่งออกมาจากเซลล์ที่เกี่ยวเนื่องกับการอักเสบ โดยเฉพาะอย่างยิ่ง นิวโตรฟิลอีลาสเตส ซึ่งเป็นเอนไซม์ที่ถูกหลั่งออกมาเพื่อทำลายแบคทีเรียแปลกปลอม และอาจทำให้เนื้อเยื่อปกติของร่างกายได้รับความเสียดายได้ นอกจากนี้ A1AT ยังสามารถจับกับอีลาสเตสบนผิวเซลล์ที่ทำหน้าที่ถ่ายโอนสัญญาณในการกระตุ้นการเคลื่อนที่ของเซลล์ภูมิคุ้มกันอื่นได้ด้วย
A1AT มีค่าอ้างอิงในกระแสเลือดระหว่าง 0.9–2.3 กรัม/ลิตร (ในสหรัฐ ค่านี้จะแสดงในหน่วย มิลลิกรัม/เดซิลิตร หรือไมโครโมล) แต่ค่าความเข้มข้นนี้อาจเพิ่มขึ้นในภาวะที่มีการอักเสบเฉียบพลัน กรณีที่มีปริมาณหรือการทำหน้าที่ของ A1AT ผิดปกติ เช่น ในภาวะพร่องแอลฟาวัน-แอนติทริปซิน จะทำให้มีนิวโตรฟิลอีลาสเตสในรูปอิสระมากเกินไปจนก่อให้เกิดความเสียหายแก่อีลาสติน เป็นผลให้เนื้อเยื่อปอดมีความยืดหยุ่นลดน้อยลง และเกิดความผิดปกติของระบบทางเดินหายใจได้ในที่สุด อาทิ โรคปอดอุดกั้นเรื้อรัง โดยปกติแล้ว A1AT ซึ่งถูกสร้างที่ตับจะเข้าสู่กระแสเลือดเพื่อเข้าจับกับเอนไซม์เป้าหมาย แต่ในกรณีภาวะพร่องแอลฟาวัน-แอนติทริปซินนั้น A1AT จะไม่สามารถเข้าสู่กระแสเลือดได้ และทำให้เกิดโรคตับแข็งได้ในที่สุด โดยหากเกิดอาจจำเป็นต้องมีการปลูกถ่ายตับเพื่อรักษาความผิดปกติดังกล่าว นอกเหนือจากตับแล้ว A1AT ยังถูกสร้างได้โดยเซลล์ในไขกระดูก, เซลล์ลิมโฟไซต์และโมโนไซต์ในระบบน้ำเหลือง รวมไปถึงพาเนทเซลล์ในลำไส้เล็กด้วย
การยับยั้งการทำงานของ A1AT โดยเอนไซม์อื่นที่ไม่ใช่อีลาสเตสที่ถูกหลั่งออกมาในระหว่างที่มีการอักเสบหรือการติดเชื้อจะทำให้เกิดการเคลื่อนที่ของทีเซลล์ไปยังตำแหน่งที่เกิดความผิดปกติได้อย่างแม่นยำ (T cell)by ด้วยเหตุนี้ จึงพออนุมานได้ว่า นอกจาก A1AT จะมีบทบาทในการเคลื่อนที่ของลิมโฟไซต์ไปยังเนื้อเยื่อเป้าหมาย ซึ่งเป็นกระบวนการตอบสนองขั้นต้นของระบบภูมิคุ้มกัน ยังมีส่วนสำคัญต่อการกระตุ้นระบบภูมิคุ้มกันในระยะหลังด้วย
A1AT จัดเป็นทั้งสารยับยั้งโปรตีเอสที่สร้างได้ภายในร่างกายและยาที่จัดเป็นสารยับยั้งโปรตีเอสที่รับจากภายนอก โดย A1AT ในรูปแบบยาจะได้จากการสกัดจากเลือดที่ได้จากการบริจาคโลหิต และจำหน่ายในตลาดยา ทั้งภายใต้ชื่อที่ไม่เป็นกรรมสิทธิ์คือ alpha1–proteinase inhibitor และชื่อการค้าต่างๆ (ได้แก่ Aralast NP, Glassia, Prolastin, Prolastin-C และ Zemaira) นอกจากนี้ ในปัจจุบันยังมีการใช้ A1AT ที่ได้จากการสร้างดีเอ็นเอสายผสมแต่จำกัดแค่การใช้ในงานวิจัยทางการแพทย์เท่านั้น
ประวัติ
แอลฟาวัน-แอนติทริปซินถูกค้นพบครั้งแรกโดย Fermi และ Pernossi เมื่อ ค.ศ. 1894 และสามารถสกัดแยกตัวอย่างออกมาได้สำเร็จในปี ค.ศ. 1955 โดย Schultze และได้มีการกำหนดให้เรียกสารนี้ว่า แอลฟาวัน-แอนติทริปซิน เนื่องจากสารดังกล่าวสามารถสกัดได้จากแอลฟาวัน-กลอบูลินและมีความสามารถในการยับยั้งการทำงานของทริปซิน ในปี ค.ศ. 1965 Axelsson และ Laurell ได้ค้นพบว่า ความผันแปรทางพันธุกรรมของอัลลีลที่สร้าง A1AT อาจเกี่ยวข้องกับโรคที่เกิดจากความผิดปกติทางพันธุกรรมบางอย่าง
ในปี ค.ศ. 1985 ได้มีการคิดค้นระบบการตั้งชื่อของโปรตีนในกลุ่มสารที่ออกฤทธิ์ยับยั้งซีรีสโปรตีเอส (serine proteinase inhibitor) หรือเซอร์ปิน มาใช้ จึงได้มีการกำหนดชื่อให้แอลฟาวัน-แอนติทริปซิน ซึ่งเป็นโปรตีนชนิดแรกที่ถูกค้นพบในกลุ่มนี้ให้อยู่ในเคลดเอ ลำดับที่ 1 ใช้ชื่อสัญลักษณ์แทนว่า SERPINA1
บทบาทและหน้าที่
โปรตีนในกลุ่มเซอร์ปินส่วนใหญ่จะเข้าจับและยับยั้งการทำงานของเอนไซม์เป้าหมายโดยการสร้างพันธะโคเวเลนต์ ซึ่งในสภาวะปกติเอนไซม์เหล่านี้จะถูกหลั่งออกมาในระดับความเข้มข้นที่ต่ำมากและจะถูกกำจัดออกไปจากระบบโดยโปรตีนที่ต้านการทำงานของเอนไซม์เหล่านั้นได้ภายในระยะเวลาอันรวดเร็ว ซึ่ง A1AT ก็เป็นโปรตีนอีกชนิดหนึ่งที่มีการทำงานในรูปแบบดังกล่าว ในแต่สภาวะที่เกิดการอักเสบขึ้นเฉียบพลัน จะทำให้เกิดการกระตุ้นให้นิวโตรฟิลหลั่งเอนไซม์เหล่านี้มากขึ้น โดยเฉพาะเอนไซม์อีลาสเตส ทั้งเพื่อลดความเสียหายที่อาจเกิดกับเนื้อเยื่อที่เป็นผลมาจากสิ่งแปลกปลอมหรือการอักเสบนั้นๆ
นอกจากจะยับยั้งการทำงานของอีลาสเตสเพื่อไม่ให้เกิดความเสียหายกับเนื้อเยื่อมาเกินเกินไป A1AT ยังสามารถเหนี่ยวนำให้เกิดการเคลื่อนที่ของลิมโฟไซต์ผ่านเนื้อเยื่อต่างๆ ซึ่งรวมไปถึงการกระตุ้นให้ทีเซลล์ที่ยังไม่เจริญหรือไทโมไซต์ ซึ่งถูกสร้างขึ้นในไขกระดูกให้เคลื่อนที่ผ่านกระแสเลือดเพื่อไปยังต่อมไทมัส ที่ซึ่งไทโมไซต์จะถูกเปลี่ยนเป็นทีเซลล์จะถูกเปลี่ยนให้อยู่ในรูปที่เจริญเต็มที่และทำงานได้ ซึ่งจะถูกหลั่งเข้าสู่กระแสเลือดเพื่อตอบสนองปัจจัยกระตุ้นต่อไป
ความผิดปกติ

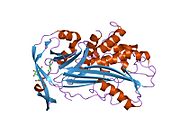
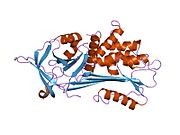
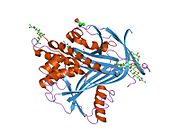
ภาพแสดงโครงสร้างผลึกของแอลฟาวัน-แอนติทริปซิน (ขาว) พร้อมกัยวงศูนย์ปฏิกิริยา (reactive centre loop; RCL – สีน้ำเงิน) และแผ่น A sheet (สีม่วงอ่อน) (PDB: 1QLP)
ความผิดปกติที่เกี่ยวเนื่องกับ A1AT รวมถึงภาวะพร่องแอลฟาวัน-แอนติทริปซิน จัดเป็นความผิดปกติทางพันธุกรรมที่ถ่ายทอดแบบยีนเด่นอีกชนิดหนึ่ง (autosomal dominant hereditary disorders) ซึ่งจะการเกิดการทำลายเนื้อเยื่อต่างๆ อย่างต่อเนื่องโดยปราศจากการยับยั้งจากสารต้านเอนไซม์ โดยเฉพาะเนื้อเยื่อปอด ซึ่งอาจทำให้เกิดโรคถุงลมโป่งพองได้ในที่สุด นอกจากนี้ยังมีหลักฐานเชิงประจักษ์ที่แสดงให้เห็นว่า การสูบบุหรี่จะทำให้เกิดการออกซิเดชันของกรดอะมิโนมีไธโอนีนตำแหน่งที่ 358 ของ A1AT ซึ่งเป็นส่วนสำคัญที่ใช้ในการเข้าจับกับเอนไซม์อีลาสเตส ด้วยเหตุผลดังข้างต้น จึงอาจคาดการณ์ได้ว่า กระบวนการดังกล่าวเป็นอีกสาเหตุหนึ่งที่ทำให้ผู้สูบบุหรี่หรือผู้สูบบุหรี่มือสองสามารถเกิดภาวะถุงลมโป่งพองได้ นอกจากนี้ เนื่องด้วย A1AT ถูกพบได้มากที่ตับ การกลายพันธุ์ของยีน SERPINA1 ที่ควบคุมการถอดรหัสการสร้าง A1AT จะทำให้เกิดการม้วนพับของสายโปรตีนและการหลั่ง A1AT ออกสู่กระแสเลือดผิดปกติ จนนำไปสู่การเกิดโรคตับแข็งในที่สุด ซึ่งความผิดปกติดังกล่าวสามารถตรวจสอบได้ด้วยการเจาะชื้นเนื้อตับเพื่อนำมาย้อมสีชนิด Periodic acid–Schiff stain (PAS) ซึ่งจะพบกลุ่มก้อนที่เกิดจากสีย้อมมากมายภายในบริเวณ periportal ของเซลล์ตับ.
นอกจากนี้ยังมีรายงานการเกิดการกลายพันธุ์ของยีน SERPINA1 โดยเกิดการแทนที่กรดอะมิโนมีไธโอนีนที่ตำแหน่ง 358 ด้วยอาร์จินีน ซึ่งทำให้ A1AT ที่เกิดการกลายพันธุ์นี้ (α1-Antitrypsin Pittsburgh; PiPittsburgh) มีฤทธิ์คล้ายแอนติทรอมบิน III คือ ต้านการทำงานของทรอมบิน เป็นผลให้เกิดภาวะเลือดออกง่าย และเสียชีวิตได้ในที่สุด
ในผู้ป่วยโรคข้ออักเสบรูมาตอยด์พบว่ามีการสร้างภูมิต้านเนื้อเยื่อตนเองขึ้นมาในน้ำไขข้อเพื่อต้าน A1AT ที่ผ่านการเกิดปฏิกิริยาคาร์บามิเลชั่นแล้ว (carbamylated A1AT) ซึ่งบ่งชี้ได้ว่า A1AT อาจมีบทบาทในการต้านการอักเสบหรือปกป้องเนื้อเยื่ออื่นๆ อีกนอกเหนือจากเนื้อเยื่อปอด โดยภูมิต้านทานดังกล่าวมีความสัมพันธ์กันกับอาการของโรคที่รุนแรงขึ้น ซึ่งจะสามารถติดตามวัดค่าได้หลายปีก่อนที่จะเริ่มมีการแสดงอาการของโรค และอาจใช้ทำนายการพัฒนาของโรคในผู้ป่วยกลุ่มดังกล่าวได้ ดังนั้น ในปัจจุบันจึงมีการพัฒนาวิธีการตรวจวัด carbamylated A1AT เพื่อใช้เป็นตัวบ่งชี้ทางชีวภาพ (antigenic biomaker) ในกลุ่มผู้ป่วยดังกล่าว
การกลายพันธุ์
A1AT มีน้ำหนักโมเลกุลประมาณ 52-กิโลดัลตัน ทั้งชนิดที่เป็นเซอร์ปินในร่างกายและชนิดที่จัดเป็นยา จัดเป็นเซอร์ปินที่มีความโดดเด่นและเป็นที่สนใจในการศึกษาทางการแพทย์ปัจจุบันมากที่สุด ถูกถอดรหัสได้จากยีน SERPINA1 ที่อยู่บนแขนข้างยาวของโครโมโซมคู่ที่ 14 (14q32.1) ความผันแปรทางพันธุกรรมของยีนในตำแหน่งดังกล่าวถูกค้นพบแล้วมากกว่า 100 รูปแบบ โดยกลุ่มประชากรในยุโรปตะวันตกเฉียงเหนือถือเป็นกลุ่มประชากรที่มีความเสี่ยงต่อการได้รีบยีนกลายพันธุ์ชนิด Z ของ SERPINA1 (Glu342Lys บน M1A, rs28929474) ซึ่งเป็นรูปแบบการกลายพันธุ์ที่พบได้มากที่สุดของยีนในตำแหน่งดังกล่าว
การใช้ประโยชน์ทางการแพทย์
ดูเพิ่ม
แหล่งข้อมูลอื่น
-
Kalsheker N (April 1989). "Alpha 1-antitrypsin: structure, function and molecular biology of the gene". Bioscience Reports. 9 (2): 129–38. doi:10.1007/BF01115992. PMID 2669992. S2CID 34243822.
-
Crystal RG (December 1989). "The alpha 1-antitrypsin gene and its deficiency states". Trends in Genetics. 5 (12): 411–7. doi:10.1016/0168-9525(89)90200-X. PMID 2696185.
-
Carrell RW, Jeppsson JO, Laurell CB, Brennan SO, Owen MC, Vaughan L, Boswell DR (July 1982). "Structure and variation of human alpha 1-antitrypsin". Nature. 298 (5872): 329–34. Bibcode:1982Natur.298..329C. doi:10.1038/298329a0. PMID 7045697. S2CID 11904305.
-
Elliott PR, Abrahams JP, Lomas DA (January 1998). "Wild-type alpha 1-antitrypsin is in the canonical inhibitory conformation". Journal of Molecular Biology. 275 (3): 419–25. doi:10.1006/jmbi.1997.1458. PMID 9466920.
-
Miyamoto Y, Akaike T, Maeda H (March 2000). "S-nitrosylated human alpha(1)-protease inhibitor". Biochimica et Biophysica Acta (BBA) - Protein Structure and Molecular Enzymology. 1477 (1–2): 90–7. doi:10.1016/S0167-4838(99)00264-2. PMID 10708851.
-
Coakley RJ, Taggart C, O'Neill S, McElvaney NG (January 2001). "Alpha1-antitrypsin deficiency: biological answers to clinical questions". The American Journal of the Medical Sciences. 321 (1): 33–41. doi:10.1097/00000441-200101000-00006. PMID 11202478. S2CID 2458903.
-
Lomas DA, Lourbakos A, Cumming SA, Belorgey D (April 2002). "Hypersensitive mousetraps, alpha1-antitrypsin deficiency and dementia". Biochemical Society Transactions. 30 (2): 89–92. doi:10.1042/BST0300089. PMID 12023831.
-
Kalsheker N, Morley S, Morgan K (April 2002). "Gene regulation of the serine proteinase inhibitors alpha1-antitrypsin and alpha1-antichymotrypsin". Biochemical Society Transactions. 30 (2): 93–8. doi:10.1042/BST0300093. PMID 12023832.
-
Perlmutter DH (December 2002). "Liver injury in alpha1-antitrypsin deficiency: an aggregated protein induces mitochondrial injury". The Journal of Clinical Investigation. 110 (11): 1579–83. doi:10.1172/JCI16787. PMC 151639. PMID 12464659.
-
Lomas DA, Mahadeva R (December 2002). "Alpha1-antitrypsin polymerization and the serpinopathies: pathobiology and prospects for therapy". The Journal of Clinical Investigation. 110 (11): 1585–90. doi:10.1172/JCI16782. PMC 151637. PMID 12464660.
-
Lisowska-Myjak B (February 2005). "AAT as a diagnostic tool". Clinica Chimica Acta; International Journal of Clinical Chemistry. 352 (1–2): 1–13. doi:10.1016/j.cccn.2004.03.012. PMID 15653097.
-
Lomas DA (2005). "Molecular mousetraps, alpha1-antitrypsin deficiency and the serpinopathies". Clinical Medicine. 5 (3): 249–57. doi:10.7861/clinmedicine.5-3-249. PMC 4952210. PMID 16011217.
-
Rudnick DA, Perlmutter DH (September 2005). "Alpha-1-antitrypsin deficiency: a new paradigm for hepatocellular carcinoma in genetic liver disease". Hepatology. 42 (3): 514–21. doi:10.1002/hep.20815. PMID 16044402.
|
เฉลียงภาพ PDB
|
|---|
1atu: UNCLEAVED ALPHA-1-ANTITRYPSIN
1d5s: CRYSTAL STRUCTURE OF CLEAVED ANTITRYPSIN POLYMER
1ezx: CRYSTAL STRUCTURE OF A SERPIN:PROTEASE COMPLEX
1hp7: A 2.1 ANGSTROM STRUCTURE OF AN UNCLEAVED ALPHA-1-ANTITRYPSIN SHOWS VARIABILITY OF THE REACTIVE CENTER AND OTHER LOOPS
1iz2: Interactions causing the kinetic trap in serpin protein folding
1oo8: CRYSTAL STRUCTURE OF A1PI-PITTSBURGH IN THE NATIVE CONFORMATION
1oph: NON-COVALENT COMPLEX BETWEEN ALPHA-1-PI-PITTSBURGH AND S195A TRYPSIN
1psi: INTACT RECOMBINED ALPHA1-ANTITRYPSIN MUTANT PHE 51 TO LEU
1qlp: 2.0 ANGSTROM STRUCTURE OF INTACT ALPHA-1-ANTITRYPSIN: A CANONICAL TEMPLATE FOR ACTIVE SERPINS
1qmb: CLEAVED ALPHA-1-ANTITRYPSIN POLYMER
2d26: Active site distortion is sufficient for proteinase inhibit second crystal structure of covalent serpin-proteinase complex
7api: THE S VARIANT OF HUMAN ALPHA1-ANTITRYPSIN, STRUCTURE AND IMPLICATIONS FOR FUNCTION AND METABOLISM
8api: THE S VARIANT OF HUMAN ALPHA1-ANTITRYPSIN, STRUCTURE AND IMPLICATIONS FOR FUNCTION AND METABOLISM
9api: THE S VARIANT OF HUMAN ALPHA1-ANTITRYPSIN, STRUCTURE AND IMPLICATIONS FOR FUNCTION AND METABOLISM
|
|
|
|---|
| สารยับยั้ง |
|
| สารยับยั้งข้ามกลุ่ม |
|
| ไม่ใช่สารยับยั้ง |
|
|