มาลาเรีย
| มาลาเรีย (Malaria) | |
|---|---|
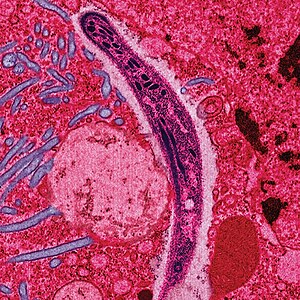 | |
| Plasmodium ในรูปที่เข้าสู่มนุษย์และสัตว์มีกระดูกสันหลังอื่นจากน้ำลายของยุงเพศเมีย (สปอโรซอยต์) ตัดขวางกับไซโทพลาสซึมของเซลล์เยื่อบุทางเดินอาหารส่วนกลางของยุง | |
| การออกเสียง | |
| สาขาวิชา | Infectious disease |
| อาการ | ไข้, อาเจียน, ปวดศีรษะ |
| ภาวะแทรกซ้อน | ตัวเหลือง, ชัก, โคม่า |
| การตั้งต้น | 10–15 วันหลังได้รับเชื้อ |
| สาเหตุ | จากเชื้อพลาสโมเดียม มียุงเป็นพาหะ |
| วิธีวินิจฉัย | การตรวจดูเชื้อในเม็ดเลือด, การตรวจหาแอนติเจนมาลาเรีย |
| การป้องกัน | มุ้งกันยุง, ยากันยุง, การควบคุมพันธุ์ยุง, ยาป้องกันโรค |
| ยา | ยาต้านมาลาเรีย |
| ความชุก | 216 ล้านคนทั่วโลก (พ.ศ. 2559) |
| การเสียชีวิต | 730,500 คนทั่วโลก (พ.ศ. 2558) |
มาลาเรีย (อังกฤษ: malaria) หรือไข้จับสั่น ไข้ป่า ไข้ป้าง ไข้ร้อนเย็นหรือไข้ดอกสัก เป็นโรคติดเชื้อของมนุษย์และสัตว์อื่นที่มียุงเป็นพาหะ มีสาเหตุจากปรสิตโปรโตซัว (จุลินทรีย์เซลล์เดียวประเภทหนึ่ง) ในสกุล Plasmodium (พลาสโมเดียม) อาการทั่วไปคือ มีไข้ อ่อนเพลีย อาเจียนและปวดศีรษะ ในรายที่รุนแรงอาจทำให้ตัวเหลือง ชัก โคม่าหรือเสียชีวิตได้ โรคมาลาเรียส่งผ่านโดยการกัดของยุงเพศเมียในสกุล Anopheles (ยุงก้นปล่อง) และปกติอาการเริ่ม 10 ถึง 15 วันหลังถูกกัด หากไม่ได้รับการรักษาอย่างเหมาะสม บุคคลอาจมีอาการของโรคในอีกหลายเดือนให้หลัง ในผู้ที่เพิ่งรอดจากการติดเชื้อ การติดเชื้อซ้ำมักมีอาการเบากว่า การต้านทานบางส่วนนี้จะหายไปในเวลาเป็นเดือนหรือปีหากบุคคลไม่ได้สัมผัสมาลาเรียอย่างต่อเนื่อง
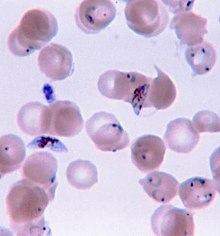
เมื่อถูกยุง Anopheles เพศเมียกัดจะนำเชื้อปรสิตจากน้ำลายของยุงเข้าสู่เลือดของบุคคล ปรสิตจะไปตับซึ่งจะเจริญเติบโตและสืบพันธุ์ มนุษย์สามารถติดเชื้อและส่งต่อ Plasmodium ห้าสปีชีส์ ผู้เสียชีวิตส่วนมากเกิดจากเชื้อ P. falciparum เพราะ P. vivax, P. ovale และ P. malariae โดยทั่วไปก่อให้เกิดมาลาเรียแบบที่รุนแรงน้อยกว่า สปีชีส์รับจากสัตว์ P. knowlesi พบมากในเอเชียตะวันออกเฉียงใต้ การวินิจฉัยมาลาเรียตรงแบบทำโดยการตรวจเลือดด้วยกล้องจุลทรรศน์โดยใช้ฟิล์มเลือดหรือการวินิจฉัยชนิดรวดเร็ว (rapid diagnostic test) ที่อาศัยแอนติเจน มีการพัฒนาวิธีซึ่งใช้ปฏิกิริยาลูกโซ่พอลิเมอเรสเพื่อตรวจจับดีเอ็นเอของปรสิต แต่ยังไม่มีใช้แพร่หลายในพื้นที่ซึ่งมีโรคมาลาเรียทั่วไปเนื่องจากราคาแพงและซับซ้อน
ความเสี่ยงของโรคลดได้โดยการป้องกันไม่ให้ถูกยุงกัด โดยใช้มุ้งหรือสารขับไล่แมลง หรือด้วยมาตรการควบคุมยุง เช่น การฉีดพ่นยาฆ่าแมลงหรือการระบายน้ำนิ่ง มียารักษาโรคหลายชนิดที่ป้องกันมาลาเรียในผู้ที่เดินทางไปยังบริเวณที่พบโรคมาลาเรียทั่วไป แนะนำให้ใช้ยารักษาโรคซัลฟาด็อกซีน/ไพริเมธามีนบางครั้งในทารกและหลังไตรมาสแรกของการตั้งครรภ์ในบริเวณซึ่งมีโรคมาลาเรียอัตราสูง โรคมาลาเรียยังไม่มีวัคซีน แต่กำลังพัฒนา การรักษาโรคมาลาเรียที่แนะนำ คือ การใช้ยาต้านมาลาเรียหลายชนิดร่วมกันซึ่งรวมอาร์ตีมิซินิน ยาชนิดที่สองอาจเป็นเมโฟลควิน ลูมีแฟนทรีนหรือซัลฟาด็อกซีน/ไพริเมธามีน อาจใช้ควินินร่วมกับด็อกซีไซคลินได้หากไม่มีอาร์ติมิซินิน แนะนำว่าในพื้นที่ซึ่งมีโรคมาลาเรียทั่วไป ให้ยืนยันโรคมาลาเรียหากเป็นไปได้ก่อนเริ่มการรักษาเนื่องจากความกังวลว่ามีการดื้อยาเพิ่มขึ้น มีการพัฒนาการดื้อยาในปรสิตต่อยาต้านมาลาเรียหลายชนิด เช่น P. falciparum ซึ่งดื้อต่อคลอโรควินได้แพร่ไปยังพื้นที่ซึ่งมีการระบาดมากที่สุด และการดื้อยาอาร์ทีมิซินินเป็นปัญหาในบางพื้นที่ของเอเชียตะวันออกเฉียงใต้
โรคนี้แพร่หลายในเขตร้อนและอบอุ่นซึ่งอยู่เป็นแถบกว้างรอบเส้นศูนย์สูตร ซึ่งรวมพื้นที่แอฟริกาใต้สะฮารา ทวีปเอเชียและละตินอเมริกาบริเวณกว้าง โรคมาลาเรียมักสัมพันธ์กับความยากจนและยังอาจเป็นอุปสรรคต่อการพัฒนาเศรษฐกิจ ในทวีปแอฟริกา มีการประเมินว่ามีการสูญเสีย 12,000 ล้านดอลลาร์สหรัฐต่อปีเนื่องจากค่าใช้จ่ายสาธารณสุขเพิ่มขึ้น เสียความสามารถการทำงาน และผลเสียต่อการท่องเที่ยวองค์การอนามัยโลกประเมินว่ามีผู้ป่วย 198 ล้านคน ใน พ.ศ. 2556 มีผู้เสียชีวิตด้วยโรคมาลาเรียระหว่าง 584,000 ถึง 855,000 คน ส่วนใหญ่ (90%) เกิดในทวีปแอฟริกา
อาการและอาการแสดง
ปกติอาการและอาการแสดงของมาลาเรียจะเริ่มต้น 8–25 วันหลังการติดเชื้อ อย่างไรก็ดี อาการอาจเกิดขึ้นหลังจากนี้ในผู้ที่ทานยาต้านมาลาเรียป้องกันไว้ก่อน การแสดงเริ่มต้นของโรคเป็นอาการคล้ายหวัด ซึ่งเหมือนกันในมาลาเรียทุกสปีชีส์ และสามารถเหมือนกับอาการป่วยอื่น เช่น ภาวะเลือดเป็นพิษ กระเพาะอาหารและลำไส้เล็กอักเสบ และโรคไวรัส การแสดงอาการอาจรวมปวดศีรษะ เป็นไข้ สั่น ปวดในข้อ อาเจียน โลหิตจางเพราะเม็ดเลือดแดงแตก ดีซ่าน มีฮีโมโกลบินในปัสสาวะ จอตาเสียหายและการชัก
อาการตรงต้นแบบของมาลาเรีย คือ อาการกำเริบ ซึ่งเป็นการเกิดการหนาวฉับพลัน ตามด้วยการสั่น และไข้และเหงื่อออกเป็นวัฏจักร แต่ละสปีชีส์มีความถี่ต่างกัน ในการติดเชื้อ P. vivax และ P. ovale อาการกำเริบทุกสองวัน P. malariae อาการกำเริบทุกสามวัน การติดเชื้อ P. falciparum สามารถเกิดไข้กลับทุก 36–48 ชั่วโมงหรือไข้แทบไม่สร่าง
มาลาเรียรุนแรงปกติเกิดจาก P. falciparum อาการแสดงของมาลาเรียประเภทนี้เริ่มขึ้น 9–30 วันหลังการติดเชื้อ บุคคลที่มีมาลาเรียขึ้นสมอง (cerebral malaria) มักแสดงอาการทางระบบประสาทบ่อยครั้ง ซึ่งรวมถึงท่าร่างผิดปกติ อาการตากระตุกแกว่ง อัมพาตเมื่อดูด้วยสองตา (ตาไม่สามารถกลอกไปในทิศทางเดียวกัน) อาการเกร็งหลังแอ่น ชักหรือโคม่า
ภาวะแทรกซ้อน
โรคมาลาเรียมีภาวะแทรกซ้อนรุนแรงหลายอย่าง ภาวะแทรกซ้อนหนึ่งคือการพัฒนาการหายใจอึดอัด ซึ่งเกิดขึ้นมากถึง 25% ในผู้ใหญ่ และ 40% ในเด็กที่ป่วยด้วยมาลาเรียชนิด P. falciparum รุนแรง สาเหตุอาจเนื่องจากการชดเชยภาวะเลือดเป็นกรดเมตะบอลิกด้วยการหายใจ ปอดบวมน้ำที่ไม่ได้มีสาเหตุจากโรคหัวใจ ปอดบวมเกิดร่วม และโลหิตจางรุนแรง กลุ่มอาการหายใจลำบากเฉียบพลันพบได้ 5–25% ของผู้ใหญ่ และมากถึง 29% ของสตรีมีครรภ์ ทว่าพบน้อยในเด็กเล็กที่ป่วยเป็นโรคมาลาเรียรุนแรง การติดเชื้อเอชไอวีร่วมกับมาลาเรียเพิ่มอัตราตาย ภาวะไตล้มเหลวเป็นลักษณะของไข้น้ำดำ ซึ่งฮีโมโกลบินจากเม็ดเลือดแดงที่แตกรั่วออกสู่ปัสสาวะ
การติดเชื้อ P. falciparum อาจส่งผลให้เกิดมาลาเรียขึ้นสมอง ซึ่งเป็นรูปแบบของมาลาเรียรุนแรงที่มีโรคสมองร่วมด้วย ภาวะดังกล่าวสัมพันธ์กับจอตาขาว (retinal whitening) ซึ่งอาจเป็นอาการแสดงทางคลินิกที่มีประโยชน์ในการแยกมาลาเรียจากสาเหตุอื่นของไข้ นอกจากนี้ยังอาจเกิดม้ามโต ปวดศีรษะรุนแรง ตับโต น้ำตาลในเลือดต่ำ และมีฮีโมโกลบินในปัสสาวะร่วมกับไตล้มเหลวได้
มาลาเรียในสตรีมีครรภ์เป็นสาเหตุสำคัญของการตายคลอด ทารกตายและมีน้ำหนักแรกคลอดต่ำ โดยเฉพาะอย่างยิ่งในการติดเชื้อ P. falciparum แต่การติดเชื้อ P. vivax ก็พบได้
สาเหตุ
ปรสิตมาลาเรียเป็นสิ่งมีชีวิตในสกุล Plasmodium (ไฟลัม Apicomplexa) P. falciparum, P. malariae, P. ovale, P. vivax และ P. knowlesi เป็นสาเหตุของมาลาเรียในมนุษย์ ซึ่งในสปีชีส์เหล่านี้ P. falciparum เป็นสปีชีส์ที่พบมากที่สุด (~75%) รองลงมาคือ P. vivax (~20%) แม้ว่าเดิม P. falciparum เป็นชนิดที่ทำให้มีผู้เสียชีวิตมากที่สุด แต่หลักฐานปัจจุบันเสนอว่า มาลาเรีย P. vivax สัมพันธ์กับภาวะที่อาจอันตรายถึงชีวิตได้บ่อยครั้งเท่ากับการวินิจฉัยการติดเชื้อ P. falciparum มาลาเรีย P. vivax พบนอกทวีปแอฟริกามากกว่าโดยสัดส่วน มีการบันทึกการติดเชื้อมาลาเรียพลาสโมเดียมสปีชีส์ที่มาจากลิงไม่มีหางชั้นสูงในมนุษย์ อย่างไรก็ดี สปีชีส์เหล่านี้ส่วนใหญ่มีความสำคัญทางสาธารณสุขน้อย โดยยกเว้น P. knowlesi ซึ่งเป็นสปีชีส์รับจากสัตว์ที่ก่อโรคมาลาเรียในลิงมาคาก
ภาวะโลกร้อนน่าจะส่งผลต่อการส่งผ่านโรคมาลาเรีย แต่ความรุนแรงและการกระจายทางภูมิศาสตร์ของผลดังกล่าวยังไม่แน่ชัด
วงจรชีวิต
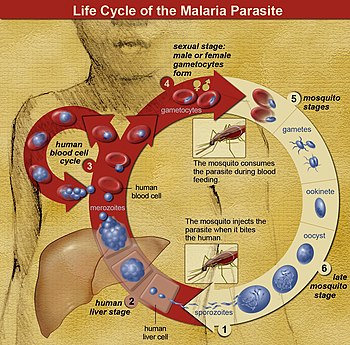
ในวงจรชีวิตของ Plasmodium ยุงก้นปล่องเพศเมีย (ตัวถูกเบียนแท้) ส่งผ่านระยะติดต่อที่เคลื่อนที่ได้ (เรียก สปอโรซอยต์) มายังตัวถูกเบียนสัตว์มีกระดูกสันหลัง เช่น มนุษย์ (ตัวถูกเบียนมัธยันตร์) ฉะนั้นยุงก้นปล่องจึงเป็นเสมือนตัวนำโรคแพร่เชื้อ สปอโรซอยต์เดินทางผ่านเส้นเลือดไปยังเซลล์ตับ ที่ซึ่งมันจะสืบพันธุ์แบบไม่อาศัยเพศ (เรียกว่า tissue schizogony) ทำให้ได้เมอโรซอยต์นับหลายพันเซลล์ เมอโรซอยต์เหล่านี้เข้าไปติดเซลล์เม็ดเลือดแดงใหม่และเริ่มต้นวงจรการเพิ่มจำนวนแบบไม่อาศัยเพศ (เรียกว่า blood schizogony) ซึ่งทำให้ได้เมอโรซอยต์ที่สามารถติดเชื้อได้ใหม่ 8 ถึง 24 เซลล์ ในระยะนี้ เซลล์จะระเบิดและวงจรการติดเชื้อเริ่มต้นใหม่
เมอโรซอยต์อื่นเจริญไปเป็นแกมีโตไซต์ที่ยังเจริญไม่เต็มที่ (immature gametocyte) ซึ่งเป็นเซลล์ต้นกำเนิดของเซลล์สืบพันธุ์เพศผู้และเพศเมีย เมื่อยุงกัดมนุษย์ แกมีโตไซต์จะถูกดูดจากเลือดและไปเจริญในทางเดินอาหารของยุง แกมีโตไซต์เพศผู้และเพศเมียผสมกันและก่อเป็นโอโอไคนีต (ookinete) ซึ่งเป็นไซโกตที่ได้รับการผสมและเคลื่อนที่ได้ จากนั้นโอโอไคนีตเจริญไปเป็นสปอโรซอยต์ใหม่ที่จะเคลื่อนที่ไปยังต่อมน้ำลายของยุง และพร้อมที่จะติดเชื้อตัวถูกเบียนสัตว์มีกระดูกสันหลังใหม่ เมื่อยุงดูดเลือดอีก สปอโรซอยต์ในน้ำลายจะถูกฉีดเข้าสู่ผิวหนัง
เฉพาะยุงเพศเมียเท่านั้นที่ดูดเลือด ส่วนยุงเพศผู้กินน้ำต้อยของพืชเป็นอาหาร ฉะนั้นจึงไม่ส่งต่อโรค ยุงก้นปล่องเพศเมียมักดูดเลือดในยามกลางคืน โดยปกติเริ่มค้นหาอาหารในช่วงเย็น และจะค้นหาต่อไปทั้งคืนจนกว่าจะได้ดูดเลือด ปรสิตมาลาเรียยังสามารถส่งผ่านได้โดยการถ่ายเลือด แม้จะพบน้อยก็ตาม
มาลาเรียกลับเป็นซ้ำ
อาการแสดงของมาลาเรียสามารถกลับเป็นซ้ำได้หลังจากช่วงที่ไม่มีอาการแสดงต่าง ๆ กัน การกลับเป็นซ้ำนี้สามารถจำแนกตามสาเหตุได้เป็นการกลับกำเริบ การเป็นโรคกลับหรือการติดเชื้อซ้ำ การกลับกำเริบคือ การที่กลับแสดงอาการอีกครั้งหลังช่วงที่ไม่แสดงอาการ ซึ่งเกิดจากปรสิตที่ยังหลงเหลืออยู่ในเลือดซึ่งเป็นผลจากการรักษาที่ไม่เพียงพอหรือไม่มีประสิทธิภาพ การเป็นโรคกลับคือการที่กลับแสดงอาการหลังปรสิตถูกกำจัดหมดไปจากเลือดแล้วแต่ยังคงอยู่เป็นฮิพโนซอยต์แฝงในเซลล์ตับ การเป็นโรคกลับมักเกิดระหว่าง 8–24 สัปดาห์และมักพบในการติดเชื้อ P. vivax และ P. ovale ผู้ป่วยมาลาเรียชนิด P. vivax ในเขตอบอุ่นมักสัมพันธ์กับการที่ฮิพโนซอยต์มีชีวิตอยู่ในฤดูหนาว โดยการเป็นโรคกลับเริ่มต้นในปีถัดจากปีที่ถูกยุงกัด การติดเชื้อซ้ำหมายถึงปรสิตที่ก่อการติดเชื้อครั้งก่อนได้ถูกกำจัดหมดไปจากร่างกายแล้ว แต่มีการได้รับปรสิตใหม่เข้ามา การติดเชื้อซ้ำไม่สามารถแยกจากการกลับกำเริบได้ทันที แม้ว่าการกลับติดเชื้อซ้ำภายในสองสัปดาห์ของการรักษาการติดเชื้อครั้งแรกมักมีสาเหตุจากความล้มเหลวในการรักษา บุคคลอาจแสดงภูมิคุ้มกันระยะสั้น (premunity) ในกรณีการติดเชื้อซ้ำได้
พยาธิกำเนิด
โรคมาลาเรียในมนุษย์มีสองระยะ ระยะหนึ่งอยู่นอกเม็ดเลือดแดง คืออยู่ในเซลล์ตับ อีกระยะหนึ่งอยู่ในเม็ดเลือดแดง เมื่อยุงที่ติดเชื้อมาลาเรียไปดูดเลือดจากมนุษย์ สปอโรซอยต์ในน้ำลายของยุงตัวนั้นจะเข้าไปสู่กระแสเลือด แล้วเชื้อจะเดินทางไปตับ เมื่อไปถึงแล้ว เชื้อจะเข้าไปอยู่ในเซลล์ตับ และจะเพิ่มจำนวนแบบไม่อาศัยเพศโดยไม่แสดงอาการเป็นเวลา 8–30 วัน
หลังระยะสงบอยู่ในตับ เชื้อมาลาเรียจะเปลี่ยนแปลงไปให้เมอโรซอยต์หลายพันเซลล์ เมื่อเซลล์ตัวถูกเบียนแตก เมอโรซอยต์เหล่านี้จะเล็ดรอดเข้าสู่กระแสเลือดเพื่อเริ่มวงจรชีวิตระยะในเม็ดเลือดแดง เชื้อนี้ออกจากตับโดยเอาเยื่อหุ้มเซลล์ของเซลล์ตับคลุมตัวเองไว้ ภูมิคุ้มกันจึงไม่สามารถตรวจจับได้
ในเม็ดเลือดแดง เชื้อจะเพิ่มจำนวนแบบไม่อาศัยเพศอีกครั้ง เมื่อได้จำนวนมากถึงระดับหนึ่งก็จะทำให้เม็ดเลือดแดงแตกออก และเชื้อจำนวนมากก็จะถูกแพร่เข้าสู่กระแสเลือดไปสู่เม็ดเลือดแดงใหม่ต่อไป แต่ละครั้งที่เม็ดเลือดแดงแตกออกและมีเชื้อจำนวนมากเข้าสู่กระแสเลือดพร้อมกัน ผู้ป่วยจะมีไข้เป็นระยะ ซึ่งช่วงของการเกิดไข้จะเป็นไปแล้วแต่ชนิดของเชื้อ การมีไข้จับเป็นระยะนี้เอง ที่เรียกว่า "จับไข้"
สปอโรซอยต์ P. vivax บางส่วนไม่เจริญไปเป็นเมอโรซอตยต์ระยะนอกเม็ดเลือดแดงทันที แต่จะผลิตฮิปโนซอยต์ (hypnozoite) ซึ่งสงบอยู่ระยะหนึ่งตั้งแต่หลายเดือน (ปกติ 7–10 เดือน) ถึงหลายปี หลังระยะสงบอยู่ ฮิปโนซอยต์จะกลับมาพัฒนาไปเป็นเมอโรซอนต์อีก ฮิปโนซอยต์เป็นสาเหตุที่การติดเชื้อ P. vivax มีระยะฟักนานและการเป็นโรคกลับภายหลัง ยังไม่ทราบแน่ชัดว่า P. ovale มีระยะฮิปโนซอยต์ด้วยหรือไม่
ปรสิตมาลาเรียแทบไม่ถูกระบบภูมิคุ้มกันของร่างกายกำจัด เพราะวงจรชีวิตในมนุษย์ส่วนใหญ่อยู่ในเซลล์ตับและเซลล์เม็ดเลือดแดง ทำให้ภูมิคุ้มกันของร่างกายตรวจไม่พบ อย่างไรก็ดี เซลล์เม็ดเลือดที่ติดเชื้อจะถูกกรองและทำลายทิ้งที่ม้าม ซึ่งเป็นการทำลายเชื้อได้ทางหนึ่ง อย่างไรก็ดี เชื้อ P. falciparum มีวิธีหลบหลีกจากกระบวนการของร่างกายดังกล่าวโดยปรสิตจะมีการสร้างโปรตีนยึดเกาะบนผิวเซลล์เม็ดเลือดแดง ทำให้เม็ดเลือดแดงที่ติดเชื้อไปติดอยู่กับผนังหลอดเลือดขนาดเล็ก ซึ่งทำให้เม็ดเลือดติดเชื้อนั้นไม่ถูกกำจัดที่ม้าม การอุดกั้นหลอดเลือดขนาดเล็กก่อให้เกิดอาการ เช่น ในมาลาเรียรก (placental malaria) เซลล์เม็ดเลือดแดงที่ติดผนังหลอดเลือดขนาดเล็กนี้สามารถเจาะผ่าน blood–brain barrier และทำให้เกิดมาลาเรียขึ้นสมอง (cerebral malaria) ได้
ความต้านทานทางพันธุกรรม
ตามการทบทวนในปี 2548 โรคมาลาเรียได้สร้างความกดดันการคัดเลือกที่ยิ่งใหญ่ที่สุดต่อจีโนมมนุษย์ในประวัติศาสตร์ล่าสุด เนื่องจากระดับอัตราตายและอัตราการเกิดโรคจากมาลาเรียสูง โดยเฉพาะอย่างยิ่งชนิด P. falciparum ปัจจัยทางพันธุกรรมหลายอย่างให้ความต้านทานมาลาเรียบ้าง เช่น ลักษณะเซลล์รูปเคียว ลักษณะธาลัสซีเมีย ภาวะพร่องกลูโคส-6-ฟอสเฟต ดีไฮโดรจีเนส และการขาดแอนติเจนดัฟฟีบนเม็ดเลือดแดง
ผลกระทบของลักษณะเซลล์รูปเคียวต่อภูมิคุ้มกันมาลาเรียแสดงถึงการแลกเปลี่ยนทางวิวัฒนาการซึ่งเกิดขึ้นเพราะมาลาเรียประจำถิ่น ลักษณะเซลล์รูปเคียวก่อให้เกิดความบกพร่องในโมเลกุลฮีโมโกลบินในเลือด โมเลกุลเอสที่เปลี่ยนแปลงของฮีโมโกลบินทำให้เซลล์กลายเป็นรูปเคียวหรือบิดเบี้ยวเป็นทรงโค้ง ขณะที่เม็ดเลือดแดงปกติจะคงทรงเว้าเข้าหากัน เนื่องจากทรงรูปเคียว เม็ดเลือดแดงจึงมีประสิทธิภาพรับหรือปล่อยออกซิเจนด้อยกว่าปกติ การติดเชื้อมาลาเรียทำให้เม็ดเลือดแดงเป็นทรงเคี้ยวยิ่งขึ้น ฉะนั้นจึงถูกขจัดออกจากระบบไหลเวียนโลหิตเร็วขึ้น จึงเป็นการลดความถี่ซึ่งปรสิตมาลาเรียจะครบวงจรชีวิตในเซลล์ บุคคลที่เป็นฮอโมไซกัส (คือ มีแอลลีลฮีโมโกลบินบีตาที่ผิดปกติสองแอลลีล) จะเป็นโลหิตจางเม็ดเลือดแดงรูปเคียว ขณะที่ผู้ที่เป็นเฮเทอโรไซกัส (คือ มีแอลลีลปกติและผิดปกติอย่างละหนึ่ง) จะมีความต้านทานต่อมาลาเรีย แม้ว่าความคาดหมายการคงชีพของผู้มีสภาพฮอโมไซกัสจะไม่ดำรงความอยู่รอดของลักษณะดังกล่าว แต่ลักษณะนี้ยังสืบทอดมาเพราะประโยชน์จากแบบเฮเทอโรไซกัส
การทำหน้าที่ผิดปรกติของตับ
การทำหน้าที่ผิดปรกติของตับอันเป็นผลจากมาลาเรียนั้นพบไม่บ่อยและโดยปกติเกิดเฉพาะในผู้ที่มีภาวะของตับอื่นอยู่ก่อนแล้ว เช่น ตับอักเสบจากไวรัสหรือโรคตับเรื้อรัง กลุ่มอาการดังกล่าวบางครั้งเรียก ตับอักเสบมาลาเรีย (malarial hepatitis) แม้ว่าจะถูกมองว่าเป็นเหตุการณ์ที่เกิดขึ้นน้อย แต่พบโรคตับมาลาเรียมากขึ้น โดยเฉพาะอย่างยิ่งในเอเชียตะวันออกเฉียงใต้และอินเดีย ความไวของตับในผู้ป่วยมาลาเรียสัมพันธ์กับโอกาสมีภาวะแทรกซ้อนและการเสียชีวิตมากขึ้น
การวินิจฉัย
เนื่องจากมาลาเรียแสดงอาการไม่จำเพาะ การวินิจฉัยมาลาเรียนอกพื้นที่ประจำถิ่นต้องมีความสงสัยระดับสูง ซึ่งอาจค้นหาได้จากต่อไปนี้ ประวัติเดินทางล่าสุด ม้ามโต มีไข้ เกล็ดเลือดในเลือดต่ำ และมีระดับบิลิรูบินในเลือดสูงกว่าปกติร่วมกับระดับเม็ดเลือดขาวปกติ
มักยืนยันมาลาเรียด้วยการตรวจฟิล์มเลือดด้วยกล้องจุลทรรศน์ หรือด้วยการทดสอบวินิจฉัยรวดเร็ว (RDT) โดยใช้แอนติเจน จุลทรรศนศาสตร์เป็นวิธีที่ใช้มากที่สุดเพื่อตรวจจับปรสิตมาลาเรีย โดยในปี 2553 มีการตรวจฟิล์มเลือดเพื่อหามาลาเรียราว 165 ล้านฟิล์ม แม้ว่าจะมีการใช้แพร่หลาย การวินิจฉัยด้วยจุลทรรศนศาสตร์มีข้อเสียหลักสองประการ คือ หลายสถานที่ (โดยเฉพาะอย่างยิ่งในชนบท) ไม่มีเครื่องมือเพียงพอที่จะดำเนินการทดสอบ และความแม่นของผลขึ้นอยู่กับทั้งทักษะของผู้ตรวจฟิล์มเลือดและระดับปรสิตในเลือด ความไวของฟิล์มเลือดมีพิสัยตั้งแต่ 75–90% ในสภาพเหมาะที่สุด ไปจนถึง 50% ชุดน้ำยาตรวจอย่างรวดเร็วที่มีขายเชิงพาณิชย์มักทำนายการมีปรสิตมาลาเรียได้แม่นกว่าฟิล์มเลือด แต่ชุดน้ำยาตรวจดังกล่าวมีความไวและความจำเพาะวินิจฉัยแปรผันขึ้นอยู่กับผู้ผลิต และไม่สามารถบอกได้ว่ามีปรสิตมากเท่าใด
ในท้องที่ที่การทดสอบทางห้องปฏิบัติการมีพร้อมแล้ว ควรตั้งข้อสงสัยหรือทดสอบหามาลาเรียในผู้ป่วยทุกคนที่อยู่ในพื้นที่ซึ่งมีมาลาเรียประจำถิ่น ในพื้นที่ซึ่งไม่สามารถจ่ายการทสอบวินิจฉัยทางห้องปฏิบัติการได้ การใช้เพียงประวัติไข้เพื่อเป็นการบ่งชี้การรักษามาลาเรียกลายเป็นปกติ ซึ่งเป็นคำสอนปกติ "ไข้เท่ากับมาลาเรียเว้นแต่พิสูจน์ได้เป็นอย่างอื่น" ข้อเสียของการปฏิบัตินี้คือ การวินิจฉัยมาลาเรียเกินความเป็นจริงและการจัดการกับไข้ที่ไม่ได้สาเหตุจากมาลาเรียอย่างผิด ๆ ซึ่งสิ้นเปลืองทรัพยากรอันจำกัด บั่นทอนความเชื่อมั่นในระบบสาธารณสุขและส่งเสริมการดื้อยา แม้จะมีการพัฒนาการทดสอบที่ใช้ปฏิกิริยาลูกโซ่พอลิเมอเรสขึ้น แต่ในปี 2555 การทดสอบดังกล่าวยังไม่มีใช้แพร่หลายในพื้นที่ซึ่งพบมาลาเรียเป็นปกติ เนื่องจากเป็นวิธีที่ซับซ้อน
การจำแนก
องค์การอนามัยโลกจำแนกมาลาเรียเป็น "มีอาการรุนแรง" หรือ "ไม่มีอาการแทรกซ้อน" หากเข้าข่ายเกณฑ์ด้านล่างนี้แม้แต่ข้อหนึ่งให้เป็นมาลาเรียที่มีอาการรุนแรง มิฉะนั้นให้ถือเป็นมาลาเรียที่ไม่มีอาการแทรกซ้อน
- ความรู้สึกตัวลดลง
- อ่อนเพลียมากจนไม่สามารถเดินได้
- ไม่สามารถกินอาหารเองได้
- ชักมากกว่าหนึ่งครั้ง
- ความดันโลหิตต่ำ (น้อยกว่า 70 มม.ปรอทในผู้ใหญ่ และ 50 มม.ปรอทในเด็ก)
- หายใจลำบาก
- ช็อกจากการไหลเวียนโลหิต
- ไตล้มเหลวหรือมีฮีโมโกลบินในปัสสาวะ
- มีเลือดออก หรือฮีโมโกลบินน้อยกว่า 50 ก./ลิตร (5 ก./เดซิลิตร)
- ปอดบวมน้ำ
- กลูโคสในเลือดน้อยกว่า 2.2 มิลลิโมลาร์/ลิตร (40 มก./เดซิลิตร)
- ภาวะกระเดียดกรดหรือระดับแลกเตดสูงกว่า 5 มิลลิโมลาร์/ลิตร)
- ระดับปรสิตในเลือดสูงกว่า 100,000 ต่อไมโครลิตรในพื้นที่ส่งผ่านความเข้มต่ำ (low-intensity transmission area) หรือ 250,000 ต่อไมโครลิตรในพื้นที่ส่งผ่านความเข้มสูง (high-intensity transmission area)
มาลาเรียขึ้นสมองนิยามว่าเป็นมาลาเรียชนิด P. falciparum ที่มีอาการรุนแรงซึ่งแสดงด้วยอาการทางประสาทวิทยา รวมถึงโคม่า (โดยมีแบบประเมินความรู้สึกตัวของกลาสโกวน้อยกว่า 11 หรือแบบประเมินความรู้สึกตัวแบลนไทร์มากกว่า 3) หรือโคม่าที่กินเวลานานกว่า 30 นาทีหลังชัก
การป้องกัน
วิธีซึ่งใช้ป้องกันมาลาเรีย ได้แก่ ยารักษาโรค การกำจัดยุงและการป้องกันไม่ให้ถูกยุงกัด ไม่มีวัคซีนมาลาเรีย มาลาเรียจะมีในพื้นที่ซึ่งมีความหนาแน่นของประชากรมนุษย์สูง มีความหนาแน่นของประชากรยุงก้นปล่องสูงและอัตราการส่งผ่านจากมนุษย์สู่ยุงและจากยุงสู่มนุษย์สูง หากปัจจัยข้อหนึ่งข้อใดลดลงมากพอ ปรสิตมาลาเรียจะหายไปจากพื้นที่นั้นในที่สุด ดังที่เกิดขึ้นแล้วในทวีปอเมริกาเหนือ ทวีปยุโรปและตะวันออกกลางบางส่วน ทว่า แม้ว่าปรสิตมาลาเรียจะถูกกำจัดหมดไปจากโลกแล้ว ปรสิตก็อาจกลับมาหากสภาวะต่าง ๆ กลับเอื้ออำนวยต่อการสืบพันธุ์ของปรสิตอีก ยิ่งไปกว่านั้น ราคาต่อคนของการกำจัดยุงก้นปล่องเพิ่มขึ้นเมื่อความหนาแน่นของประชากรลดลง ทำให้วิธีดังกล่าวไม่คุ้มค่าทางเศรษฐกิจในบางพื้นที่
การป้องกันมาลาเรียอาจคุ้มค่ากว่าการรักษาโรคในระยะยาว แต่ประชากรยากจนที่สุดของโลกไม่สามารถจ่ายราคาเริ่มต้นได้ ราคาการควบคุม (ให้ความประจำถิ่นต่ำ) และโครงการกำจัดในแต่ละประเทศมีผลต่างกว้าง ตัวอย่างเช่น ในประเทศจีน ซึ่งรัฐบาลในปี 2553 ประกาศยุทธศาสตร์ในการกำจัดมาลาเรียในจีน การลงทุนที่กำหนดเป็นสัดส่วนน้อยของรายจ่ายสาธารณะด้านสาธารณสุข ในทางตรงข้าม โครงการคล้ายกันในประเทศแทนซาเนียจะมีมูลค่าประเมินไว้หนึ่งในห้าของงบประมาณสาธารณสุข
การควบคุมตัวนำโรค
การควบคุมตัวนำโรค หมายถึง วิธีซึ่งใช้ลดมาลาเรียด้วยการลดระดับการส่งผ่านโดยยุง สำหรับการป้องกันส่วนบุคคล สารขับไล่แมลงอันทรงประสิทธิภาพที่สุดอาศัยดีอีอีทีหรือพิคาริดิน มีการแสดงแล้วว่า มุ้งชุบยาฆ่าแมลงและการพ่นเคมีชนิดมีฤทธิตกค้าง (indoor residual spraying) มีประสิทธิภาพสูงในการป้องกันมาลาเรียในเด็กในพื้นที่ซึ่งพบมาลาเรียทั่วไป การรักษาผู้ป่วยยืนยันแล้วอย่างทันท่วงทีด้วยการรักษาแบบผสมที่อาศัยอาร์ติมิซินินยังอาจลดการส่งผ่านได้
มุ้งช่วยกันยุงจากมนุษย์และลดอัตราการติดเชื้อและส่งผ่านมาลาเรีย มักชุบมุ้งด้วยยาฆ่าแมลงซึ่งออกแบบมาเพื่อฆ่ายุงก่อนยุงหาทางผ่านมุ้งได้ มีการประเมินว่ามุ้งชุบยาฆ่าแมลงมีประสิทธิภาพเป็นสองเท่าของมุ้งที่ไม่ได้ชุบยาและให้การป้องกันดีกว่าการไม่ใช้มุ้ง 70% ระหว่างปี 2543 ถึง 2551 มุ้งชุบยาฆ่าแมลงช่วยชีวิตทารก 250,000 คนโดยประมาณในแอฟริกาใต้สะฮารา ครัวเรือนราว 13% ในประเทศใต้สะฮารามีมุ้งชุบยาฆ่าแมลง ในปี 2543 มุ้งป้องกันเด็กแอฟริกา 1.7 ล้านคน (1.8%) ที่อาศัยอยู่ในสภาวะมาลาเรียประจำถิ่นคงตัว จำนวนเด็กแอฟริกาที่ใช้มุ้งชุบยาฆ่าแมลงเพิ่มขึ้นเป็น 20.3 ล้านคน (18.5%) ในปี 2550 ทว่าอีก 89.6 ล้านคนยังไม่ได้รับการป้องกัน ในปี 2551 มีการประเมินว่าครัวเรือนแอฟริกา 31% มีมุ้งชุบยาฆ่าแมลงอย่างน้อยหนึ่งหลัง มุ้งส่วนมากถูกชุบด้วยไพรีทรอยด์ ซึ่งเป็นยาฆ่าแมลงชนิดมีพิษต่ำ การใช้ที่แนะนำคือให้แขวนมุ้งไว้เหนือกลางเตียงให้แขวนอยู่เหนือเตียงทั้งหมดโดยพับขอบเข้า มุ้งชุบไพรีทรอยต์และมุ้งชุบยาฆ่าแมลงที่ออกฤทธิ์นานให้การป้องกันอย่างดีที่สุด และมีประสิทธิภาพมากที่สุดเมื่อใช้ตั้งแต่เย็นถึงเช้า
การพ่นเคมีชนิดมีฤทธิตกค้างเป็นการพ่นยาฆ่าแมลงบนผนังภายในบ้าน หลังดูดเลือดแล้ว ยุงจำนวนมากจะพักบนพื้นผิวใกล้เคียงขณะย่อย ฉะนั้นหากฉาบผนังบ้านด้วยยาฆ่าแมลง ยุงที่พักอยู่จะตายก่อนที่จะทันได้กัดคนอื่นและส่งผ่านปรสิตมาลาเรีย ในปี 2549 องค์การอนามัยโลกแนะนำให้ใช้ยาฆ่าแมลง 12 ชนิดในการพ่นเคมีชนิดมีฤทธิตกค้าง รวมถึงดีดีทีและไซฟลูทรินและเดลตาเมทรินในกลุ่มไพรีทรอยด์อนุสัญญาสต็อกโฮล์มอนุญาตให้ใช้ดีดีทีปริมาณน้อยในทางสาธารณสุข แต่ห้ามการใช้ในทางการเกษตร ปัญหาหนึ่งของการพ่นเคมีชนิดมีฤทธิตกค้างทุกรูปแบบ คือ การดื้อยาฆ่าแมลง ยุงที่ได้รับผลกระทบจากการพ่นเคมีชนิดมีฤทธิตกค้างมีแนวโน้มพักและอาศัยอยู่ในอาคาร และเนื่องจากการระคายเคืองอันเกิดจากการฉีดพ่น ลูกหลานของมันมีแนวโน้มจะพักและอาศัยอยู่นอกอาคารมากกว่า หมายความว่า พวกมันจะได้รับผลกระทบจากการพ่นเคมีชนิดมีฤทธิตกค้างน้อยกว่า
มีวิธีอื่นอีกหลายวิธีในการลดยุงกัดและชะลอการระบาดของมาลาเรีย ความพยายามลดลูกน้ำโดยลดการเข้าถึงแหล่งน้ำเปิดซึ่งเป็นที่เจริญของยุงหรือโดยการเพิ่มสารเพื่อลดการเจริญของยุงนั้นมีประสิทธิภาพในบางที่ ไม่มีหลักฐานสนับสนุนอุปกรณ์ขับไล่ยุงอิเล็กทรอนิกส์ซึ่งสร้างเสียงความถี่สูงมากซึ่งน่าจะช่วยไล่ยุงเพศเมีย
วิธีการอื่น
มีการใช้วิธีการมีส่วนร่วมของชุมชนและยุทธศาสตร์สุขศึกษาซึ่งเสริมสร้างความตระหนักมาลาเรียและความสำคัญของมาตรการควบคุมเพื่อลดอุบัติการณ์ของมาลาเรียในโลกกำลังพัฒนาบางพื้นที่อย่างได้ผล การรับรู้โรคในระยะต้น ๆ สามารถหยุดไม่ให้โรคถึงตายได้ การศึกษายังสามารถแจ้งประชาชนให้ปิดบริเวณน้ำนิ่ง เช่น แทงก์น้ำ ซึ่งเป็นแหล่งผสมพันธุ์ชั้นดีสำหรับปรสิตและยุง ฉะนั้นจึงลดความเสี่ยงของการส่งผ่านระหว่างมนุษย์ได้ วิธีการนี้โดยทั่วไปใช้ในเขตเมืองซึ่งมีศูนย์ประชากรขนาดใหญ่ในพื้นที่จำกัดและมีแนวโน้มการส่งผ่านในพื้นที่เหล่านี้มาก การบำบัดป้องกันมีเว้นระยะ (intermittent preventive therapy) เป็นอีกการช่วยเหลือหนึ่งที่ใช้เพื่อควบคุมมาลาเรียในสตรีมีครรภ์และทารก และเด็กก่อนวัยเรียนซึ่งการส่งผ่านเป็นแบบตามฤดูกาลได้สำเร็จ
ยารักษาโรค
มียาหลายชนิดที่สามารถช่วยป้องกันมาลาเรียขณะเดินทางไปยังถิ่นระบาดได้ ยาเหล่านี้ส่วนมากบางครั้งใช้ในการรักษาด้วย คลอโรควินอาจใช้ได้ในที่ซึ่งปรสิตยังไวต่อยา เนื่องจาก Plasmodium ส่วนใหญ่ดื้อต่อยารักษาโรคตั้งแต่หนึ่งชนิดขึ้นไป จึงมักใช้ยาหนึ่งในสามชนิดนี้ เมโฟลควิน (ลาเรียม) ดอกซีไซคลีน หรือการรวมอะโตวาโควนและโพรกวานิลไฮโดรคลอไรด์ (มาลาโรน) ผู้ป่วยสามารถทนฤทธิ์ยาดอกซีไซคลินและการรวมอะโตวาโควนและโพรกวานิลได้ดีที่สุด เมโฟลควินสัมพันธ์กับการเสียชีวิต การฆ่าตัวตาย และอาการทางประสาทวิทยาและจิตเวช
ผลคุ้มครองยังไม่เริ่มทันที และผู้ที่จะเดินทางไปยังพื้นที่ถิ่นระบาดของมาลาเรียปกติทานยาหนึ่งถึงสองสัปดาห์ก่อนเดินทางไปและยังทานต่อไปสี่ถึงหกสัปดาห์หลังเดินทางกลับ (ยกเว้นอะโตวาโควน/โพรกวานิล ซึ่งต้องเริ่มสองวันก่อนเดินทางและทานต่อเนื่องเป็นเวลาเจ็ดวันจากนั้น) การใช้ยาคุ้มครองแทบไม่ได้ผลสำหรับผู้ที่อาศัยอยู่ในบริเวณที่มีมาลาเรียอยู่แล้ว และปกติใช้เฉพาะในผู้เดินทางและนักท่องเที่ยวระยะสั้นเท่านั้น ทั้งนี้ เนื่องจากราคายา ผลข้างเคียงจากการใช้ระยะยาว และความยากในการได้มาซึ่งยาต้านมาลาเรียในประเทศยากจน การใช้ยาคุ้มครองในที่ซึ่งมียุงที่เป็นตัวนำโรคมาลาเรียอาจส่งเสริมให้มีการพัฒนาการดื้อยาบางส่วน (partial resistance)
การรักษา
มาลาเรียรักษาด้วยยารักษาโรคต้านมาลาเรีย ยาที่ใช้ขึ้นอยู่กับประเภทและความรุนแรงของโรค แม้ว่ามีการใช้ยาลดไข้ทั่วไป แต่ผลของยาต่อผลลัพธ์นั้นไม่ชัดเจน
มาลาเรียชนิดไม่มีอาการแทรกซ้อนอาจรักษาด้วยยารักษาโรคทางปาก การรักษาการติดเชื้อ P. falciparum ที่ได้ผลที่สุด คือ การใช้อาร์ตีมิซินินรวมกับยาต้านมาลาเรียอื่น (รู้จักกันในชื่อ การบำบัดรวมอาร์ตีมิซินิน [artemisinin-combination therapy หรือ ACT]) ซึ่งลดการดื้อยาต่อส่วนประกอบยาเดี่ยว ๆ ยาต้านมาลาเรียเพิ่มเหล่านี้ได้แก่ เอโมไดอาควิน ลูมิแฟนทริน เมโฟลควินหรือซัลฟาดอกซิน/ไพริเมทามีน การรวมอีกแบบหนึ่งที่แนะนำ คือ ไดไฮโดรอาร์ตีมิซินินและไพเพอราควิน ACT ใช้รักษามาลาเรียชนิดไม่มีอาการแทรกซ้อนได้ผลราว 90% องค์การอนามัยโลกแนะนำให้ใช้ควินินและคลินดามัยซินในการรักษามาลาเรียขณะตั้งครรภ์ช่วงแรก (ไตรมาสที่ 1) และ ACT ในช่วงหลัง (ไตรมาสที่ 2 และ 3) เมื่อใช้รักษามาลาเรียระหว่างการต้งครรภ์ ในคริสต์ทศวรรษ 2000 มีมาลาเรียที่ดื้ออาร์ตีมิซินินบางส่วนเกิดขึ้นในเอเชียตะวันออกเฉียงใต้
การติดเชื้อ P. vivax, P. ovale หรือ P. malariae ปกติรักษาโดยไม่ต้องอยู่โรงพยาบาล การรักษา P. vivax ต้องมีทั้งการรักษาระยะเลือด (ด้วยคลอโรควินหรือ ACT) ตลอดจนการรักษาเชื้อในรูปตับด้วยไพรมาควิน
การรักษามาลาเรียชนิดรุนแรงที่แนะนำ คือ การใช้ยาต้านมาลาเรียในหลอดเลือดดำ สำหรับมาลาเรียชนิดรุนแรง อาร์ตีซูเนตให้ผลดีกว่าควินินทั้งในเด็กและผู้ใหญ่ การรักษามาลาเรียชนิดรุนแรงเกี่ยวข้องกับมาตรการประคับประคองซึ่งควรทำในหน่วยอภิบาล ซึ่งรวมการจัดการไข้สูงเกินและการชักซึ่งอาจเกิดจากมาลาเรีย นอกจากนี้ ยังรวมการเฝ้าดูอาการหายใจเร็วกว่าปกติ น้ำตาลในเลือดต่ำ และโพแทสเซียมในเลือดต่ำด้วย
การดื้อยา
การดื้อยาเป็นปัญหาที่เพิ่มขึ้นของการรักษามาลาเรียในคริสต์ศตวรรษที่ 21 ปัจจุบัน การดื้อยาพบทั่วไปต่อยาต้านมาลาเรียทุกกลุ่ม ยกเว้นอาร์ตีมิซินิน การรักษาสายพันธุ์ดื้อยาต้องอาศัยยากลุ่มนี้มากขึ้น ราคาของอาร์ตีมิซินินทำให้มีการใช้ในประเทศกำลังพัฒนาจำกัด สายพันธุ์มาลาเรียที่พบตรงชายแดนกัมพูชา-ไทยดื้อต่อการบำบัดรวมซึ่งรวมอาร์ตีมิซินิน ฉะนั้นจึงอาจรักษาไม่ได้เลย การสัมผัสประชากรปรสิตต่อการบำบัดด้วยอาร์ตีมิซินินอย่างเดียว (artemisinin monotherapy) ในขนาดต่ำกว่ารักษาโรคได้เกิน 30 ปีและการมีอาร์ตีมิซินินต่ำกว่ามาตรฐานมีแนวโน้มผลักดันการเลือกฟีโนไทป์ที่ดื้อยา การดื้ออาร์ตีมิซินินพบแล้วในประเทศกัมพูชา พม่า ไทยและเวียดนาม
การพยากรณ์โรค

|
<10
0–100
100–500
500–1000
1000–1500
1500–2000
2000–2500 |
2500–2750
2750–3000
3000–3250
3250–3500
≥3500
ไม่มีข้อมูล |
เมื่อรักษาอย่างเหมาะสม ผู้ป่วยมาลาเรียสามารถคาดหมายการฟื้นตัวอย่างสมบูรณ์ ทว่า มาลาเรียรุนแรงสามารถดำเนินอย่างรวดเร็วยิ่งและทำให้เสียชีวิตได้ในไม่กี่ชั่วโมงหรือวัน ในผู้ป่วยมาลาเรียที่รุนแรงที่สุด อัตราป่วยตายอาจถึง 20% แม้ได้รับการอภิบาลและรักษาก็ตาม ในระยะยาว มีบันทึกความบกพร่องทางการเจริญในเด็กที่ป่วยเป็นมาลาเรียรุนแรงหลายครั้ง การติดเชื้อเรื้อรังโดยไม่เป็นโรครุนแรงสามารถเกิดได้ในกลุ่มอาการภูมิคุ้มกันบกพร่องซึ่งสัมพันธ์กับการตอบสนองที่ลดลงต่อแบคทีเรียซัลโมเนลลาและไวรัสเอ็ปไตน์–บาร์
ในวัยเด็ก มาลาเรียทำให้เกิดโลหิตจางระหว่างการเจริญของสมองที่รวดเร็ว และยังก่อความเสียหายโดยตรงต่อสมองอันเกิดจากมาลาเรียขึ้นสมอง ผู้รอดชีวิตจากมาลาเรียขึ้นสมองบางส่วนมีความเสี่ยงต่อความบกพร่องทางประสาทวิทยาและการรู้ ความผิดปกติทางพฤติกรรมและโรคลมชักเพิ่มขึ้น มาตรการป้องกันโรคมาลาเรียแสดงแล้วว่าช่วยพัฒนาการทำหน้าที่การรู้และผลการเรียนในการทดลองทางคลินิกเมื่อเทียบกับกลุ่มยาหลอก
ระบาดวิทยา
องค์การอนามัยโลกประเมินว่าในปี 2553 มีผู้ป่วยมาลาเรีย 219 ล้านคน มีผู้เสียชีวิต 660,000 คน องค์การอื่นประเมินจำนวนผู้ป่วยไว้ระหว่าง 350 ถึง 550 ล้านคนสำหรับมาลาเรียชนิดฟัลซิปารัม และมีผู้เสียชีวิต 1.24 ล้านคนในปี 2553 เพิ่มขึ้นจาก 1.0 ล้านคนในปี 2533 ผู้ป่วยส่วนใหญ่ (65%) เป็นเด็กอายุน้อยกว่า 15 ปี สตรีมีครรภ์ราว 125 ล้านคนเสี่ยงต่อการติดเชื้อทุกปี ในแอฟริกาใต้สะฮารา มาลาเรียของมารดาสัมพันธ์กับการเสียชีวิตของทารกที่ประเมินถึง 200,000 คนต่อปี มีผู้ป่วยมาลาเรียราว 10,000 คนต่อปีในยุโรปตะวันตก และ 1,300–1,500 คนต่อปีในสหรัฐอเมริกา ราว 900 คนเสียชีวิตจากโรคในทวีปยุโรประหว่างปี 2536 ถึง 2546 ทั้งอุบัติการณ์ของโรคทั่วโลกและอัตราตายอันเกิดจากโรคลดลงในช่วงหลัง ตามข้อมูลองค์การอนามัยโลก การเสียชีวิตจากโรคมาลาเรียในปี 2553 ลดลงกว่าหนึ่งในสามจากปี 2543 ซึ่งประเมินไว้ 985,000 คน ส่วนใหญ่เนื่องจากการใช้มุ้งชุบยาฆ่าแมลงและการบำบัดผสมผสานยึดอาร์ตีมิซินิน ในปี 2555 มีผู้ป่วยมาลาเรีย 207 ล้านคน ในปีนั้น ประมาณว่ามีผู้เสียชีวิตจากโรคระหว่าง 473,000 ถึง 789,000 คน ซึ่งจำนวนมากเป็นเด็กในทวีปแอฟริกา ความพยายามลดโรคมาลาเรียในทวีปแอฟริกานับแต่เริ่มสหัสวรรษใหม่มีผลบางส่วน โดยอัตราโรคในทวีปแอฟริกาลดลงโดยประมาณ 40%
มาลาเรียปัจจุบันประจำถิ่นในแถบกว้างรอบเส้นศูนย์สูตร ในพื้นที่ทวีปอเมริกา หลายส่วนของทวีปเอเชีย และส่วนใหญ่ของทวีปแอฟริกา พบการเสียชีวิตจากมาลาเรีย 85–90% ในแอฟริกาใต้สะฮารา ประเมินปี 2552 รายงานว่าประเทศที่มีอัตราตายสูงสุดต่อประชากร 100,000 คน คือ ไอวอรีโคสต์ (86.15) แองโกลา (56.93) และบูร์กินาฟาโซ (50.66) ประเมินปี 2553 ชี้ว่าประเทศที่มีการเสียชีวิตจากมาลาเรียมากที่สุดต่อประชากร คือ ประเทศบูร์กินาฟาโซ โมซัมบิกและมาลีโครงการแอตลัสมาลาเรียมุ่งทำแผนที่ระดับประจำถิ่นทั่วโลกของมาลาเรีย โดยเป็นวิธีใช้ตัดสินการจำกัดตามพื้นที่ทั่วโลกของโรคและประเมินภาระโรค ความพยายามนี้นำไปสู่การพิมพ์เผยแพร่แผนที่ภาวะประจำถิ่นของ P. falciparum ในปี 2553 ซึ่งราว 100 ประเทศมีมาลาเรียประจำถิ่น ทุกปี นักเดินทางระหว่างประเทศ 125 ล้านคนเดินทางเข้าประเทศเหล่านี้ และกว่า 30,000 คนสัมผัสโรค
การกระจายทางภูมิศาสตร์ของมาลาเรียในภูมิภาคขนาดใหญ่มีความซับซ้อน และพื้นที่ที่มีมาลาเรียกับพื้นที่ปลอดมาลาเรียมักพบติดกัน มาลาเรียชุกในเขตร้อนและกึ่งเขตร้อนเพราะปริมาณฝน อุณหภูมิสูงต่อเนื่องและความชื้นสูง ร่วมกับน้ำนิ่งซึ่งลูกน้ำพร้อมเจริญเป็นตัวเต็มวัย ทำให้พวกมันมีสิ่งแวดล้อมที่จำเป็นต่อการแพร่พันธุ์อย่างต่อเนื่อง ในพื้นที่ที่แห้งแล้งกว่า การระบาดของมาลาเรียสามารถทำนายได้ค่อนข้างแม่นยำโดยการทำแผนที่ปริมาณฝน มาลาเรียพบในเขตชนบทมากกว่าในเมือง ตัวอย่างเช่น หลายนครในอนุภูมิภาคลุ่มแม่น้ำโขงในเอเชียตะวันออกเฉียงใต้ปลอดมาลาเรียเป็นหลัก แต่โรคชุกในเขตชนบทหลายแห่ง รวมถึงตามเขตแดนระหว่างประเทศและชายป่า ในทางตรงข้าม มาลาเรียในทวีปแอฟริกาพบทั้งในเขตชนบทและเมือง แม้ความเสี่ยงในเมืองใหญ่จะมีต่ำกว่า
ประวัติ
แม้ปรสิตซึ่งก่อโรคมาลาเรีย P. falciparum มีมา 50,000–100,000 ปีแล้ว แต่ขนาดประชากรของปรสิตนั้นไม่เพิ่มจนราว 10,000 ปีก่อน ซึ่งพร้อมกับความก้าวหน้าทางเกษตรกรรม และการพัฒนานิคมมนุษย์ ยังพบเชื้อที่ใกล้ชิดกับปรสิตมาลาเรียมนุษย์ทั่วไปในชิมแพนซี หลักฐานบางอย่างแนะว่า มาลาเรีย P. falciparum อาจกำเนิดในกอริลลา
พบการอ้างถึงไข้ตามคาบอันเป็นเอกลักษณ์ของมาลาเรียตลอดประวัติศาสตร์ที่มีบันทึก เริ่มตั้งแต่ 2700 ปีก่อนคริสตกาลในจีน มาลาเรียอาจมีส่วนต่อความเสื่อมลงของจักรวรรดิโรมัน และมีการแพร่ระบาดในโรมมากเสียจนได้ชื่อว่า "ไข้โรมัน" บางภูมิภาคในโรมโบราณถือว่าเสี่ยงต่อโรคเพราะมีสภาพเอื้ออำนวยต่อตัวนำโรคมาลาเรีย พื้นที่ดังกล่าว เช่น ประเทศอิตาลีตอนใต้ เกาะซาร์ดีเนีย หนองปอนตีเน ภูมิภาคต่ำของอิทรูเรียฝั่ง และนครโรมตามแม่น้ำไทเบอร์ ยุงชอบน้ำนิ่งในที่เหล่านี้สำหรับเป็นแหล่งเพาะพันธุ์ สวนชลประทาน ดินคล้ายบึง น้ำไหลผ่านจากการเกษตร และปัญหาการระบายน้ำจากการสร้างถนนทำให้มีน้ำนิ่งเพิ่มขึ้น

คำว่า มาลาเรีย กำเนิดจากภาษาอิตาลีสมัยกลาง mala aria หมายถึง "อากาศเสีย" โรคนี้เดิมเรียก ไข้จับสั่น (ague) หรือไข้หนอง เนื่องจากสัมพันธ์กับบึงหนอง มาลาเรียเคยพบมากในทวีปยุโรปและอเมริกาเหนือส่วนใหญ่ แต่ปัจจุบันไม่ใช่ถิ่นระบาดแล้ว แม้ยังมีผู้ป่วยเข้าประเทศบ้าง
การศึกษาทางวิทยาศาสตร์ทำให้มีความก้าวหน้าสำคัญครั้งแรกใน พ.ศ. 2423 เมื่อแพทย์ทหารชาวฝรั่งเศสซึ่งทำงานในโรงพยาบาลทหารเมืองกงส์ต็องตีน ประเทศแอลจีเรีย ชื่อ ชาร์ล หลุยส์ อาลฟงส์ ลาฟว์ร็อง สังเกตปรสิตในเม็ดเลือดแดงของผู้ติดเชื้อมาลาเรียเป็นครั้งแรก จึงเสนอว่า มาลาเรียเกิดจากสิ่งมีชีวิตนี้ ครั้งแรกระบุว่าโพรทิสตาเป็นตัวก่อโรค จากการค้นพบนี้และภายหลัง ทำให้เขาได้รับรางวัลโนเบลสาขาสรีรวิทยาหรือการแพทย์ใน พ.ศ. 2450 ปีต่อมา การ์โลส ฟินไลย์ แพทย์ชาวคิวบาที่รักษาผู้ป่วยไข้เหลืองในกรุงอาบานาพบหลักฐานแน่นหนาว่า ยุงส่งผ่านเชื้อไปและรับมาจากมนุษย์ งานนี้มีหลังการเสนอก่อนหน้าโดยโจไซอา ซี. นอตต์ (Josiah C. Nott) และงานโดยเซอร์แพตทริก แมนซัน "บิดาเวชศาสตร์เขตร้อน" เรื่อง การแพร่เชื้อโรคเท้าช้าง
ในเดือนเมษายน พ.ศ. 2437 แพทย์ชาวสกอต เซอร์โรนัลด์ รอสเยี่ยมเซอร์แพตทริก แมนซันที่บ้านเขาบนถนนควีนแอนน์ กรุงลอนดอน การเยี่ยมครั้งนี้เป็นจุดเริ่มต้นของความร่วมมือและการวิจัยอย่างกระตือรือร้นสี่ปีซึ่งเสร็จสิ้นใน พ.ศ. 2441 เมื่อรอส ซึ่งขณะนั้นกำลังทำงานในโรงพยาบาลประธาน (Presidency General Hospital) ในโกลกาตา พิสูจน์วงจรชีวิตสมบูรณ์ของปรสิตมาลาเรียในยุง เขาจึงพิสูจน์ว่ายุงเป็นตัวนำโรคมาลาเรียในมนุษย์โดยการแสดงว่ายุงบางสปีชีส์แพร่เชื้อมาลาเรียสู่นก เขาแยกปรสิตมาลาเรียจากต่อมน้ำลายของยุงที่ดูดเลือดจากนกที่ติดเชื้อ รอสได้รับรางวัลโนเบลสาขาแพทยศาสตร์ประจำ พ.ศ. 2445 สำหรับงานนี้ หลังลาออกจากราชการแพทย์อินเดีย รอสทำงานที่โรงเรียนเวชศาสตร์เขตร้อนลิเวอร์พูลและเป็นผู้นำความพยายามเพื่อควบคุมมาลาเรียในประเทศอียิปต์ ปานามา กรีซและมอริเชียส ภายหลังคณะกรรมการแพทย์อันมีวัลเทอร์ รีดเป็นผู้นำยืนยันการค้นพบของฟินไลย์และรอสใน พ.ศ. 2443 วิลเลียม ซี. กอร์แกส (William C. Gorgas) นำการแนะนำของคณะกรรมการฯ ไปปฏิบัติในมาตรการสุขภาพที่ดำเนินระหว่างการก่อสร้างคลองปานามา งานสาธารณสุขนี้ช่วยชีวิตคนงานหลายพันคนและช่วยพัฒนาวิธีที่ใช้ในการรณรงค์สาธารณสุขต่อโรคในภายหน้า
การรักษามาลาเรียที่ได้ผลอย่างแรกมาจากเปลือกต้นซิงโคนา (cinchona) ซึ่งมีควินิน ต้นไม้นี้ขึ้นบนที่ลาดของเทือกเขาแอนดีส ในประเทศเปรูเป็นหลัก ชนพื้นเมืองของเปรูนำสารละลายแอลกอฮอล์ซิงโนามาควบคุมไข้ พบประสิทธิภาพต่อมาลาเรียและคณะเยสุอิตนำการรักษานี้มาทวีปยุโรปราว พ.ศ. 2183 ใน พ.ศ. 2220 ยานี้รวมอยู่ในตำรับยาลอนดอนเป็นการรักษาต้านมาลาเรีย แต่ก็ล่วงถึง พ.ศ. 2363 จึงได้มีการแยกส่วนประกอบออกฤทธิ์ คือ ควินิน จากเปลือกไม้ แยกและตั้งชื่อโดยนักเคมีชาวฝรั่งเศส ปีแยร์ โฌแซ็ฟ เปลติเยร์ (Pierre Joseph Pelletier) และโฌแซ็ฟ บีย็องแอเม กาว็องตู (Joseph Bienaimé Caventou)
ควินินกลายเป็นยารักษาโรคมาลาเรียสำคัญจนคริสต์ทศวรรษ 1920 เมื่อเริ่มมีการพัฒนายารักษาโรคอื่น ในคริสต์ทศวรรษ 1940 ใช้คลอโรควินแทนควินินในการรักษาทั้งมาลาเรียที่ไม่มีอาการแทรกซ้อนและมาลาเรียรุนแรงจนเกิดการดื้อตามมา เริ่มแรกในเอเชียตะวันออกเฉียงใต้และทวีปอเมริกาใต้ในคริสต์ทศวรรษ 1950 และทั่วโลกในคริสต์ทศวรรษ 1980 อาร์ติมิซินิน ซึ่งค้นพบโดยนักวิทยาศาสตร์ชาวจีน ทู โหยวโหยว (Tu Youyou) และเพื่อนร่วมงานในคริสต์ทศวรรษ 1970 จากพืช Artemisia annua กลายเป็นการรักษาที่แนะนำสำหรับมาลาเรีย P. falciparum โดยให้ร่วมกับยาต้านมาลาเรียอื่นตลอดจนในโรครุนแรง
มีการใช้ Plasmodium vivax ระหว่าง พ.ศ. 2460 ถึงคริสต์ทศวรรษ 1940 เพื่อการบำบัดมาลาเรีย เป็นการฉีดปรสิตมาลาเรียโดยเจตนาเพื่อชักนำให้เกิดไข้เพื่อต่อสู้กับโรคบางชนิด เช่น ซิฟิลิสตติยภูมิ ใน พ.ศ. 2461 ผู้คิดค้นเทคนิคนี้ ยูลีอุส วักแนร์-เยาเรกก์ (Julius Wagner-Jauregg) ไดรับรางวัลโนเบลสาขาสรีรวิทยาหรือแพทยศาสตร์สำหรับการค้นพบของเขา เทคนิคนี้อันตราย ฆ่าผู้ป่วยราว 15% จึงไม่ใช้อีกต่อไป
ยาฆ่าแมลงตัวแรกที่ใช้พ่นเคมีชนิดมีฤทธิตกค้าง คือ ดีดีที แม้ทีแรกจะใช้เพื่อต่อสู้กับมาลาเรียโดยเฉพาะ แต่ได้แพร่ไปใช้ในเกษตรกรรมอย่างรวดเร็ว เมื่อเวลาผ่านไป การใช้ดีดีทีหลักกลายเป็นการควบคุมศัตรูพืชแทนการควบคุมโรค และการใช้ในการเกษตรขนานใหญ่นี้นำไปสู่วิวัฒนาการของยุงดื้อในหลายภูมิภาค การดื้อดีดีทีที่ยุงลายแสดงสามารถเทียบได้กับการดื้อยาปฏิชีวินะที่แบคทีเรียแสดง ระหว่างคริสต์ทศวรรษ 1960 ความตระหนักถึงผลลบของการใช้อย่างไม่เลือกเพิ่มขึ้น จนสุดท้ายนำไปสู่การห้ามใช้ดีดีทีในทางการเกษตรในหลายประเทศในคริสต์ทศวรรษ 1970 ก่อนหน้าดีดีที มาลาเรียถูกกำจัดหรือควบคุมได้สำเร็จในพื้นที่เขตร้อนอย่างประเทศบราซิลและอียิปต์โดยการขจัดหรือวางยาพิษแหล่งเพาะพันธุ์ยุงหรือที่อยู่ในน้ำของระยะลูกน้ำ ตัวอย่างเช่น การใช้สารประกอบสารหนูมีพิษสูง ปารีสกรีน กับสถานที่ซึ่งมีน้ำนิ่ง
วัคซีนมาลาเรียเป็นเป้าหมายการวิจัยมาแต่อดีต มีการดำเนินการศึกษาอันแรกที่มีความหวังซึ่งแสดงศักยะของวัคซีนมาลาเรียใน พ.ศ. 2510 โดยการก่อภูมิคุ้มกันหนูด้วยสปอโรซอยต์มีชีวิตที่ถูกทำให้อ่อนฤทธิ์ด้วยรังสี ซึ่งให้การคุ้มครองอย่างสำคัญแก่หนูเมื่อภายหลังฉีดด้วยสปอโรซอยต์อยู่รอดได้ปกติ นับแต่คริสต์ทศวรรษ 1970 มีความพยายามพอสมควรในการพัฒนายุทธศาสตร์การให้วัคซีนที่คล้ายกันในมนุษย์
สังคมและวัฒนธรรม
ผลกระทบทางเศรษฐกิจ
มาลาเรียมิได้เป็นเพียงโรคซึ่งสัมพันธ์โดยทั่วไปกับความยากจนเท่านั้น บางหลักฐานให้ข้อมูลว่า อาจเป็นสาเหตุของความยากจนและอุปสรรคสำคัญต่อการพัฒนาเศรษฐกิจ แม้ภูมิภาคเขตร้อนจะได้รับผลมากที่สุด ต่ออิทธิพลไกลที่สุดของมาลาเรียไปถึงเขตอบอุ่นบางส่วนซึ่งมีการเปลี่ยนแปลงฤดูกาลสุดโต่ง โรคสัมพันธ์กับผลลบทางเศรษฐกิจสำคัญต่อภูมิภาคซึ่งแพร่หลายนั้น ระหว่างปลายคริสต์ศตรวรรษที่ 19 และต้นคริสต์ศตวรรษที่ 20 โรคเป็นปัจจัยสำคัญในการชะลอการพัฒนาเศรษฐกิจในรัฐทางใต้ของสหรัฐอเมริกา
การเปรียบเทียบจีดีพีเฉลี่ยต่อหัวใน พ.ศ. 2538 ปรับความเท่าเทียมกันของอำนาจซื้อ ระหว่างประเทศที่มีมาลาเรียกับประเทศที่ไม่มีมาลาเรียมีความแตกต่างห้าเท่า ($1,526 กับ $8,268) ในช่วง พ.ศ. 2508 ถึง 2533 ประเทศที่มีมาลาเรียทั่วไปมีจีดีพีเฉลี่ยต่อหัวเพิ่มขึ้นเพียง 0.4% ต่อปี เทียบกับ 2.4% ต่อปีในประเทศอื่น
ความยากจนสามารถเพิ่มความเสี่ยงของมาลาเรีย เพราะคนยากจนไม่มีสมรรถภาพทางการเงินเพื่อป้องกันหรือรักษาโรค โดยทั้งสิ้น มีการประมาณผลกระทบทางเศรษฐกิจของมาลาเรียต่อทวีปแอฟริกาเป็นมูลค่า 12,000 ล้านดอลลาร์สหรัฐต่อปี ผลกระทบทางเศรษฐกิจนี้รวมมูลค่าสาธารณสุข วันทำงานที่เสียไปเนื่องจากการเจ็บป่วย วันที่เสียไปในการศึกษา ผลิตภาพลดลงเนื่องจากสมองเสียหายจากมาลาเรียขึ้นสมอง และการเสียการลงทุนและการท่องเที่ยว โรคมีภาระหนักในบางประเทศ ซึ่งคิดเป็น 30–50% ของการรับเข้ารักษาในโรงพยาบาล มากถึง 50% ของการเยี่ยมผู้ป่วยนอก และมากถึง 40% ของค่าใช้จ่ายสาธารณสุข
มาลาเรียขึ้นสมองเป็นสาเหตุอันดับต้น ๆ ของความพิการทางประสาทวิทยาในเด็กชาวแอฟริกา การศึกษาเปรียบเทียบการทำหน้าที่การรู้ก่อนและหลังการบำบัดการเจ็บป่วยเป็นมาลาเรียรุนแรงต่อเนื่องแสดงให้เห็นผลการเรียนและความสามารถการรู้ที่พร่องอย่างสำคัญแม้หลังฟื้นตัวแล้ว ผลคือ มาลาเรียรุนแรงและมาลาเรียขึ้นสมองมีผลลัพธ์ทางสังคม-เศรษฐกิจกว้างขวางเกินผลทันทีของโรค
ยาปลอมและยาไม่ได้มาตรฐาน
พบการปลอมอย่างแนบเนียนในหลายประเทศเอเชีย เช่น ประเทศกัมพูชา จีนอินโดนีเซีย ลาว ไทยและเวียดนาม และเป็นสาเหตุสำคัญของการเสียชีวิตที่เลี่ยงได้ในประเทศเหล่านี้ องค์การอนามัยโลกกล่าวว่า การศึกษาชี้ว่า 40% ของยารักษาโรคมาลาเรียที่มีอาร์ตีซูเนตเป็นยาปลอม โดยเฉพาะอย่างยิ่งในแถบลุ่มน้ำโขงและได้สถาปนาระบบเตือนภัยเร็วซึ่งจะรายงานสารสนเทศเกี่ยวกับยาปลอมอย่างรวดเร็วแก่เจ้าหน้าที่ที่เกี่ยวข้องในประเทศที่เข้าร่วม ไม่มีวิถีน่าเชื่อถือแก่แพทย์หรือประชาชนในการตรวจจับยาปลอมโดยปราศจากห้องปฏิบัติการ บริษัทกำลังพยายามต่อสู้กับการมียาปลอมโดยการใช้เทคโนโลยีใหม่เพื่อให้ความปลอดภัยจากแหล่งถึงการจำหน่าย
อีกความกังวลทางคลินิกและสาธารณสุขหนึ่ง คือ การเพิ่มจำนวนยาต้านมาลาเรียไม่ได้มาตรฐานอันเกิดจากความเข้มข้นของส่วนประกอบไม่เหมาะสม ปนเปื้อนด้วยยาอื่นหรือเป็นพิษ ส่วนประกอบคุณภาพต่ำและหีบห่อไม่เพียงพอ การศึกษาใน พ.ศ. 2555 แสดงว่า ยาต้านมาลาเรียราวหนึ่งในสามในเอเชียตะวันออกเฉียงใต้และแอฟริกาใต้สะฮาราไม่ผ่านการวิเคราะห์ทางเคมี หีบห่อหรือถูกพิสูจน์ว่าเป็นเท็จ
สงคราม
ตลอดประวัติศาสตร์ การติดมาลาเรียมีบทบาทสำคัญต่อชะตาของผู้นำรัฐบาล รัฐชาติ บุคลากรทางทหารและการปฏิบัติทางทหาร ในปี 2453 ผู้ได้รับรางวัลโนเบลสาขาการแพทย์ โรนัลด์ รอส (ซึ่งตัวเขาเองก็รอดชีวิตจากโรคมาลาเรีย) ตีพิมพ์หนังสือชื่อ การป้องกันมาลาเรีย ซึ่งรวมบทชื่อ "การป้องกันมาลาเรียในสงคราม" ผู้ประพันธ์บท พันเอก ซี. เอช. เมลวิล ศาสตราจารย์สุขศาสตร์แห่งราชวิทยาลัยแพทย์ทหารบกในกรุงลอนดอน กล่าวถึงบทบาทสำคัญของมาลาเรียระหว่างสงครามว่า "ประวัติศาสตร์มาลาเรียในสงครามอาจถือเป็นประวัติศาสตร์สงครามทีเดียว ประวัติศาสตร์สงครามในคริสต์ศักราชแน่นอน ... อาจเป็นไปได้กรณีที่ผู้ป่วยโรคที่เรียก ไข้ค่าย (camp fever) จำนวนมาก และอาจยังรวมโรคบิดค่ายสัดส่วนพอสมควร ในสงครามคริสต์ศตวรรษที่สิบหก สิบเจ็ดและสิบแปดกำเนิดจากมาลาเรีย"
มาลาเรียเคยเป็นภัยสุขภาพสำคัญที่สุดที่ทหารสหรัฐในแปซิฟิกใต้ประสบระหว่างสงครามโลกครั้งที่สอง ซึ่งทหารประมาณ 500,000 นายติดเชื้อ โจเซฟ แพทริก เบิร์น (Joseph Patrick Byrne) ระบุว่า "ทหารหกหมื่นนายเสียชีวิตด้วยโรคมาลาเรียระหว่างการทัพแอฟริกาและแปซิฟิกใต้"
มีการลงทุนการเงินอย่างสำคัญเพื่อจัดหาสารต้านมาลาเรียที่มีอยู่และสร้างสารใหม่ ระหว่างสงครามโลกครั้งที่หนึ่งและสงครามโลกครั้งที่สอง อุปทานไม่ต่อเนื่องของเปลือกต้นซิงโคนาและควินินอันเป็นยาต้านมาลาเรียตามธรรมชาติทำให้มีการลงทุนเพื่อวิจัยและพัฒนายาและวัคซีนอื่น องค์การทหารอเมริกาลงมือริเริ่มวิจัยดังกล่าวซึ่งรวมศูนย์วิจัยการแพทย์ทหารเรือ สถาบันวิจัยทหารบกวัลเทอร์ รีดและสถาบันวิจัยโรคติดเชื้อการแพทย์กองทัพสหรัฐแห่งกองทัพสหรัฐ
นอกเหนือจากนี้ ยังมีการริเริ่มอย่างการควบคุมมาลาเรียในพื้นที่สงคราม (MCWA) ซึ่งก่อตั้งในปี 2485 และต่อมาคือ ศูนย์โรคติดต่อ (ปัจจุบันคือ ศูนย์ควบคุมและป้องกันโรคหรือ CDC) ซึ่งก่อตั้งในปี 2489 ข้อมูลของ CDC ว่า MCWA "ตั้งขึ้นเพื่อควบคุมมาลาเรียรอบฐานฝึกทหารในสหรัฐอเมริกาภาคใต้และดินแดนของสหรัฐ ซึ่งมาลาเรียยังเป็นปัญหา"
ความพยายามกำจัด
มีความพยายามสำคัญหลายครั้งเพื่อกำจัดเชื้อมาลาเรียจากส่วนต่าง ๆ ของโลก หรือกำจัดมันทั่วโลก ในปี 2549 องค์การมาลาเรียโนมอร์ (Malaria No More) ตั้งเป้าสาธารณะกำจัดมาลาเรียจากทวีปแอฟริกาภายในปี 2558 และองค์การมีแผนยุบหากบรรลุเป้าหมายนั้น มีวัคซีนมาลาเรียหลายชนิดกำลังอยู่ในการทดลองทางคลินิกซึ่งตั้งใจให้การคุ้มครองแก่เด็กในพื้นที่ระบาดและช่วยลดความเร็วของการส่งผ่านโรค จวบจนปี 2555 กองทุนต่อสู้เอดส์ วัณโรคและมาลาเรียโลก (Global Fund to Fight AIDS, Tuberculosis and Malaria) ได้แจกจ่ายมุ้งชุบยาฆ่าแมลง 230 ล้านผืนซึ่งตั้งใจหยุดการส่งผ่านมาลาเรียจากยุง มูลนิธิคลินตันในสหรัฐอเมริกาทำงานเพื่อจัดการอุปทานและรักษาเสถียรภาพราคาในตลาดอาร์ตีมิซินิน ความพยายามอื่นอย่างโครงการมาลาเรียแอตลาส (Malaria Atlas Project) มุ่งวิเคราะห์สารสนเทศภูมิอากาศและสภาพอากาศซึ่งจำเป็นต่อการทำนายการระบาดของมาลาเรียอย่างแม่นยำโดยอาศัยการมีถิ่นที่อยู่ของปรสิตที่นำมาลาเรีย คณะกรรมการที่ปรึกษานโยบายมาลาเรียขององค์การอนามัยโลกก่อตั้งขึ้นในปี 2555 "เพื่อให้คำแนะนำทางยุทธศาสตร์และสิ่งเข้าเทคนิคแก่องค์การอนามัยโลกในทุกแง่มุมของการควบคุมและการกำจัดมาลาเรีย" ในเดือนพฤศจิกายน 2556 องค์การอนามัยโลกและกลุ่มผู้จัดหาทุนวัคซีนมาลาเรียวางเป้าหมายพัฒนาวัคซีนซึ่งออกแบบเพื่อหยุดยั้งการส่งผ่านมาลาเรียโดยมีเป้าหมายระยะยาวเพื่อกำจัดมาลาเรีย
มาลาเรียถูกกำจัดหรือลดปริมาณลงมากสำเร็จในบางพื้นที่ มาลาเรียเคยพบทั่วไปในสหรัฐอเมริกาและทวีปยุโรปตอนใต้ แต่โครงการควบคุมตัวนำโรค ร่วมกับการเฝ้าสังเกตและรักษามนุษย์ที่ติดเชื้อ ได้กำจัดโรคจากภูมิภาคเหล่านี้ มีหลายปัจจัยส่งผล เช่น การระบายแหล่งเพาะพันธุ์ในพื้นที่ชุ่มน้ำเพื่อเกษตรกรรมและการเปลี่ยนแปลงอื่นในการปฏิบัติจัดการน้ำ และความก้าวหน้าของสุขาภิบาล ซึ่งรวมการใช้กระจกแก้วและบังตามากขึ้นในที่อยู่อาศัย มาลาเรียถูกกำจัดจากส่วนใหญ่ของสหรัฐอเมริกาในต้นคริสต์ศตวรรษที่ 20 โดยวิธีการเหล่านี้ และการใช้ยาฆ่าแมลงดีดีที ตลอดจนวิธีอื่นกำจัดโรคนี้จากวงที่เหลืออยู่ทางใต้ในคริสต์ทศวรรษ 1950 ในประเทศซูรินาม มีการกวาดโรคนี้จากเมืองหลวงและพื้นที่ชายฝั่งผ่านแนวทางสามง่ามที่ริเริ่มโดยโครงการกำจัดมาลาเรียทั่วโลกในปี 2498 ซึ่งมีการควบคุมตัวนำโรคโดยการใช้ดีดีทีและไออาร์เอส การเก็บสเมียร์เลือดสม่ำเสมอจากประชากรเพื่อระบุผู้ป่วยมาลาเรียที่มีอยู่ และการให้เคมีบำบัดแก่ทุกคนที่ป่วยประเทศภูฏานกำลังใช้ยุทธศาสตร์กำจัดมาลาเรียแบบโหม และมีผู้ป่วยที่ยืนยันด้วยกล้องจุลทรรศน์ลดลง 98.7% ตั้งแต่ปี 2537 ถึง 2553 นอกเหนือจากเทคนิคควบคุมตัวนำโรคอย่างไออาร์เอสในพื้นที่ความเสี่ยงสูงและผ่านการกระจายมุ้งชุบยาฆ่าแมลงคงทนแล้ว ปัจจัยอื่นอย่างการพัฒนาเศรษฐกิจและการเพิ่มการเข้าถึงบริการสุขภาพช่วยให้ภูฏานประสบความสำเร็จในการลดอุบัติการณ์ของมาลาเรีย
การวิจัย
ความคิดริเริ่มวาระการวิจัยการกำจัดมาลาเรีย (malERA) เป็นกระบวนการให้คำปรึกษาเพื่อระบุว่าการวิจัยและพัฒนา (R&D) ในด้านใดที่ต้องพิจารณาสำหรับการกำจัดโรคมาลาเรียทั่วโลก
วัคซีน
ในปี 2549 คณะกรรมการที่ปรึกษาวัคซีนมาลาเรียขององค์การอนามัยโลกร่าง "แผนเทคโนโลยีวัคซีนมาลาเรีย" ซึ่งมีวัตถุประสงค์จุดหลักหนึ่งเพื่อ "พัฒนาและออกใบอนุญาตวัคซีนมาลาเรียรุ่นแรกซึ่งมีประสิทธิผลมากกว่า 50% ในการป้องกันอาการรุนแรงและการเสียชีวิต และคงอยู่นานกว่าหนึ่งปี" ภายในปี 2558 ต่อมาวัคซีนป้องกันโรคมาลาเรียที่มีชื่อว่า RTS,S/AS01 (RTS,S) ได้รับการอนุมัติจากหน่วยงานกำกับดูแลของยุโรปใน พ.ศ. 2558 โดยในปี 2562 อยู่ระหว่างการทดลองนำร่องใน 3 ประเทศแถบภูมิภาคแอฟริกาใต้สะฮารา ได้แก่ กานา เคนยา และมาลาวี ซึ่งเป็นส่วนหนึ่งของโครงการแผนดำเนินการวัคซีนมาลาเรีย (MVIP) ขององค์การอนามัยโลก
ภูมิคุ้มกันต่อมาลาเรีย P. falciparum เกิดเองตามธรรมชาติได้ แต่เฉพาะหลังการติดเชื้อซ้ำ ๆ หลายปี บุคคลสามารถมีภูมิคุ้มกันต่อการติดเชื้อ P. falciparum หากถูกยุงที่นำปรสิตฉบับที่ถูกการฉายรังสีเอกซ์ขนาดหนึ่งทำให้ไม่ติดเชื้อกัดประมาณหนึ่งพันครั้ง ปัจจุบันกำลังมีการพัฒนาวัคซีนหลายตัว ธรรมชาติพหุสัณฐานอย่างสูงของโปรตีน P. falciparum หลายตัวส่งผลให้เป็นความท้าทายสำคัญในการออกแบบวัคซีน วัคซีนที่มีให้เลือกซึ่งมีเป้าหมายยังเซลล์สืบพันธุ์ ไซโกตและโอโอไคนีตในทางเดินอาหารส่วนกลางของยุงมุ่งหมายเพื่อหยุดการส่งผ่านมาลาเรีย วัคซีนหยุดการส่งผ่านเหนี่ยวนำแอนติบอดีในเลือดมนุษย์ เมื่อยุงดูดเลือดจากบุคคลที่มีภูมิคุ้มกัน แอนติบอดีเหล่านี้ป้องกันปรสิตไม่ให้พัฒนาการเจริญในยุง วัคซีนตัวเลือกอื่น ซึ่งมุ่งเป้าระยะในกระแสเลือดของวงจรชีวิตของปรสิต มีประสิทธิภาพไม่เพียงพอ ตัวอย่างเช่น มีการทดสอบ SPf66 ในพื้นที่ซึ่งพบโรคทั่วไปในคริสต์ทศวรรษ 1990 แต่การทดลองแสดงว่ามันให้ผลที่ไม่เพียงพอ บริษัทเทคโนโลยีชีวภาพ ซานาเรีย กำลังพัฒนาวัคซีนทำให้อ่อนฤทธิ์ของระยะก่อนเม็ดเลือดแดงแตก PfSPZ ซึ่งใช้สปอโรซอยต์ทั้งตัวเพื่อชักนำการสนองของภูมิคุ้มกัน
ในปี 2564 นักวิจัยจากมหาวิทยาลัยออกซ์ฟอร์ดรายงานการค้นพบจากการทดลองวัคซีนป้องกันมาลาเรีย R21/Matrix-M ระยะที่ 2b ซึ่งในช่วง 12 เดือนของการติดตามผล แสดงว่ามีประสิทธิภาพถึง 77% วัคซีนนี้เป็นวัคซีนชนิดแรกที่บรรลุเป้าหมายแผนงานเทคโนโลยีวัคซีนมาลาเรียขององค์การอนามัยโลก ซึ่งวัคซีนต้องมีประสิทธิภาพอย่างน้อย 75%
ยารักษาโรค
ปรสิตมาลาเรียมีเอพิโคพลาสต์ (apicoplast) ซึ่งเป็นออร์แกเนลลส์ที่ปกติพบในพืช อยู่ในจีโนมของมัน เชื่อว่าเอพิโคพลาสต์เหล่านี้กำเนิดผ่านเอ็นโดซิมไบโอซิส (endosymbiosis) ของสาหร่ายและมีบทบาทสำคัญในเมแทบอลิซึมด้านต่าง ๆ ของตัวปรสิต เช่น ชีวสังเคราะห์กรดไขมัน พบว่าเอพิโคพลาสต์ผลิตโปรตีนกว่า 400 ชนิด และปัจจุบันกำลังสืบสวนว่าจะเป็นเป้าหมายที่เป็นไปได้สำหรับยาต้านมาลาเรียใหม่หรือไม่
เมื่อเริ่มมีปรสิตพลาสโมเดียมดื้อยา จึงกำลังมีการพัฒนายุทธศาสตร์ใหม่เพื่อต่อสู้กับโรคมาลาเรีย แนวทางหนึ่งอยู่ในการนำแอดดักต์ (adduct) กรดอะมิโนไพริดอกซาลสังเคราะห์ ซึ่งปรสิตจะรับเข้าไปจนสุดท้ายขัดขวางความสามารถในการสร้างวิตามินบีจำเป็นหลายชนิด ยาต้านมาลาเรียที่ใช้คอมเพล็กซ์โลหะสังเคราะห์กำลังได้รับความสนใจในการวิจัย
(+)-SJ733: ส่วนหนึ่งของยาทดลองกลุ่มที่ใหญ่กว่า เรียก สไปโรอินโดโลน (spiroindolone) มันยับยั้งโปรตีน ATP4 ของเม็ดเลือดแดงที่ติดเชื้อซึ่งทำให้เซลล์เหี่ยวและกลายเป็นแข็งเหมือนเซลล์แก่ ซึ่งจะกระตุ้นให้ระบบภูมิคุ้มกันกำจัดเซลล์ที่ติดเชื้อออกจากระบบดังที่สาธิตในแบบจำลองหนู ในปี 2557 มีการวางแผนการทดลองทางคลินิกขั้น 1 เพื่อประเมินโพรไฟล์ความปลอดภัยในมนุษย์โดยสถาบันการแพทย์ฮาวาร์ด ฮิวส์ (Howard Hughes Medical Institute), NITD246 และ NITD609 ก็อยู่ในกลุ่มสไปโรอินโดโลน และมีเป้าหมาย คือ โปรตีน ATP4
อื่น ๆ
ยุทธศาสตร์การควบคุมตัวนำโรคที่ไม่ใช่สารเคมีเกี่ยวข้องกับการปรับพันธุกรรมของยุงมาลาเรีย ความก้าวหน้าในเทคโนโลยีพันธุวิศวกรรมทำให้การนำดีเอ็นเอจากสิ่งมีชีวิตอื่นเข้าไปในจีโนมของยุงเป็นไปได้ แล้วลดอายุขัยของยุง หรือทำให้ยุงดื้อต่อปรสิตมาลาเรียมากขึ้น เทคนิคยุงปลอดเชื้อเป็นวิธีการควบคุมพันธุกรรมซึ่งยุงเพศผู้ปลอดเชื้อจำนวนมากถูกเพาะเลี้ยงและปล่อย เมื่อผสมพันธุ์กับยุงเพศเมียจะลดประชากรในธรรมชาติในรุ่นหลัง การปล่อยซ้ำ ๆ สุดท้ายจะกำจัดประชากรเป้าหมายได้
จีโนมิกส์เป็นหัวใจของการวิจัยมาลาเรีย ด้วยการลำดับพันธุกรรมของ P. falciparum, Anopheles gambiae ยุงตัวนำโรคชนิดหนึ่ง และจีโนมมนุษย์ ทำให้สามารถศึกษาพันธุกรรมของสิ่งมีชีวิตทั้งสามในวงจรชีวิตของมาลาเรียได้ การนำเทคโนโลยีพันธุศาสตร์ใหม่ไปใช้อีกอย่างหนึ่ง คือ ความสามารถในการสร้างยุงที่ดัดแปรพันธุกรรมซึ่งไม่ส่งผ่านมาลาเรีย ซึ่งมีศักยภาพควบคุมทางชีววิทยาซึ่งการส่งผ่านมาลาเรียได้
สัตว์อื่น
มีการระบุสปีชีส์ปรสิต Plasmodium เกือบ 200 ชนิดซึ่งติดเชื้อในนก สัตว์เลื้อยคลานและสัตว์เลี้ยงลูกด้วยนมอื่น และเกือบ 30 ชนิดที่ติดเชื้อไพรเมตที่มิใช่มนุษย์ตามธรรมชาติ ปรสิตมาลาเรียบางชนิดที่ติดเชื้อในไพรเมตที่มิใช่มนุษย์เป็นสิ่งมีชีวิตตัวแบบสำหรับปรสิตมาลาเรียของมนุษย์ เช่น P. coatneyi (เป็นแบบของ P. falciparum) และ P. cynomolgi (P. vivax) เทคนิคการวินิจฉัยที่ใช้ตรวจจับปรสิตในไพรเมตที่มิใช่มนุษย์คล้ายกันกับที่ใช้สำหรับมนุษย์ ปรสิตมาลาเรียที่ติดเชื้อในสัตว์ฟันแทะถูกใช้ในการวิจัยอย่างกว้างขวาง เช่น P. berghei มาลาเรียในนกมีผลต่อชนิดในอันดับ Passeriformes เป็นหลัก และเป็นภัยคุกคามค่อนข้างใหญ่สำหรับนกในรัฐฮาวาย หมู่เกาะกาลาปาโกสและกลุ่มเกาะอื่น ทราบว่าปรสิต P. relictum มีบทบาทในการจำกัดการกระจายและความอุดมสมบูรณ์ของนกฮาวายประจำถิ่น คาดว่าปรากฏการณ์โลกร้อนเพิ่มความชุกและการกระจายทั่วโลกของมาลาเรียในนก เพราะอุณหภูมิที่สูงขึ้นทำให้ภาวะเหมาะสมสำหรับการสืบพันธุ์ของปรสิต
ดูเพิ่ม
- Bynum WF, Overy C (1998). The Beast in the Mosquito: The Correspondence of Ronald Ross and Patrick Manson. Wellcome Institute Series in The History of Medicine. Rodopi. ISBN 978-90-420-0721-5.
- Guidelines for the treatment of malaria (3rd ed.). World Health Organization. 2015. ISBN 978-92-4-154912-7.
- วรรณกรรมที่อ้าง
- WHO (2010). "Guidelines for the Treatment of Malaria" (PDF). World Health Organization (2nd ed.). ISBN 978-9-2415-4792-5.
- Schlagenhauf-Lawlor P (2008). Travelers' Malaria. PMPH-USA. ISBN 978-1-55009-336-0.
แหล่งข้อมูลอื่น
|
คอมมอนส์ มีภาพและสื่อเกี่ยวกับ: มาลาเรีย |
- มาลาเรีย ที่เว็บไซต์ Curlie
- WHO site on malaria
- UNHCO site on malaria
- Global Malaria Action Plan (2008)
- Doctors Without Borders/Médecins Sans Frontières – Malaria information pages
- WHO/TDR Malaria Database via the Wayback Machine
- Anti-malaria and sustainable development
- Worldwide Antimalarial Resistance Network (WWARN)
| การจำแนกโรค | |
|---|---|
| ทรัพยากรภายนอก |