สแตติน

สแตติน (อังกฤษ: Statins หรือ HMG-CoA reductase inhibitors) เป็นกลุ่มของยาลดไขมันในกระแสเลือด (Hypolipidemic agents หรือ Lipid lowering agents) มีโครงสร้างเป็นสารประกอบอินทรีย์ที่ได้ทั้งจากการสังเคราะห์และจากธรรมชาติที่มีฤทธิ์ยับยั้งการทำงานของเอนไซม์ 3-hydroxy-3-methyl-glutaryl coenzyme A reductase (HMG-CoA reductase) ซึ่งเป็นเอนไซม์ในขั้นกำหนดอัตรา (rate limiting enzyme) ที่ทำหน้าที่เปลี่ยน HMG CoA เป็นสารจำพวกคอเลสเตอรอลในกระแสเลือด ดังนั้น จึงมีการนำยากลุ่มสแตตินนี้มาใช้เป็นยาลดระดับคอเลสเตอรอลในกลุ่มคนที่เสี่ยงต่อการเป็นโรคหัวใจและหลอดเลือด (cardiovascular disease) จากภาวะไขมันสูงกว่าปกติ ทั้งในรูปแบบการใช้สแตตินเพียงชนิดเดียวหรือใช้ร่วมกับยาลดไขมันในกระแสเลือดกลุ่มอื่นๆ
อย่างไรก็ตาม ความเสี่ยงต่อโรคหัวใจและหลอดเลือดที่ลดลงในผู้ที่ใช้สแตตินนั้นไม่ได้เป็นผลมาจากการลดระดับคอเลสเตอรอลในกระแสเลือดเพียงอย่างเดียว หากแต่มาจากฤทธิ์ของยาต่อระบบหัวใจและหลอดหลายอย่างรวมกัน ที่เรียกว่า ไพลโอทรอปิกเอฟเฟกต์ (pleiotropic effect) โดยเฉพาะอย่างยิ่ง ฤทธิ์ในการลดการอักเสบ เพิ่มความคงตัวของคราบพลัคไขมันที่เกาะอยู่ในผนังหลอดเลือด (atherosclerotic plaques) รวมทั้งผลจากการรบกวนกระบวนการแข็งตัวของเลือด (coagulation and fibrinolysis system)
สมาชิกในกลุ่มสแตติน

มีดังนี้
- อะโทวาสแตติน (atorvastatin-Lipitor®)
- ฟลูวาสแตติน (fluvastatin-Lescol®)
- โลวาสแตติน (lovastatin-Mevacor®, Altocor®, not marketed in the UK)
- ปราวาสแตติน (pravastatin-Pravachol®, Selektine®, Lipostat®)
- โรสุวาสแตติน (rosuvastatin-Crestor®)
- ซิมวาสแตติน (simvastatin-Zocor®, Lipex®)
- เซอริวาสแตติน (cerivastatin-Lipobay®, Baycol®)
- พิทาวาสแตติน (pitavastatin - Livalo®)
- เมวาสแตติน (Compactin, ML-236B)
- ยาผสมระหว่าง อีเซทิไมบ์ และ ซิมวาสแตติน (ezetimibe-Vytorin®)
การแบ่งประเภท
ยาลดไขมันในกระแสเลือดกลุ่มสแตตินนี้มีทั้งชนิดที่ได้มาจากธรรมชาติ, กึ่งสังเคราะห์, หรือบางชนิดได้จากการสังเคราะห์ขึ้นเองภายในห้องปฏิบัติการ โดยสแตตินที่ได้มาจากธรรมชาติ ได้แก่ โลวาสแตติน, เมวาสแตติน, และ ปราวาสแตติน สแตตินกึ่งสังเคราะห์ ได้แก่ ซิมวาสแตติน ซึ่งได้จากสารที่เกิดขึ้นจากกระบวนการสร้างโลวาสแตติน แต่ในปัจจุบันพบว่าเชื้อ Escherichia coli ที่มีการสร้างเอนไซม์ acetyltransferase มากเกินไป ส่วนสแตตินชนิดที่เหลือ คือ อะโทวาสแตติน, เซอริวาสแตติน, ฟลูวาสแตติน, โรสุวาสแตติน,และ พิทาวาสแตติน ล้วนแล้วแต่ได้จากการสังเคราะห์ขึ้นในห้องปฏิบัติการเท่านั้น
ทั้งนี้ ยาลดไขมันในกระแสเลือดกลุ่มสแตตินที่ได้จากธรรมชาตินั้น ส่วนใหญ่แล้วมักได้จากกระบวนการการหมักผลิตภัณฑ์ธรรมชาติจำพวกเห็ดรา เช่น โลวาสแตตินที่ได้จากการหมักเห็ดนางรม (oyster mushroom หรือ Pleurotus ostreatus) และจากการหมักข้าวแดงจากเชื้อราโมแนสคัส (Red Yeast Rice)
สแตตินที่ได้จากเชื้อรา
ในปัจจุบัน ยากลุ่มสแตตินนั้นสามารถถูกสร้างได้โดยเห็ดราหลายชนิด ได้แก่ Aspergillus terreus, บางสายพันธ์ของตระกูล Monascus, Penicillium, Doratomyces, Eupenicillinum, Gymnoascus, Hypomyces, Paecilomyces, Phoma, Trichoderma และ Pleurotis ในกรณีการผลิตปราวาสแตติน ในระดับอุตสาหกรรมนั้นจะใช้วิธีการเปลี่ยนแปลงโครงสร้างของเมวาสแตติน โดยกระบวนการทางชีวภาพ (bioconversion) ถึงแม้ว่าปราวาสแตตินจะสามารถสร้างขึ้นได้จากเห็ดราบางสายพันธ์ในตระกูล Aspergillus และ Monascus ก็ตาม ตารางต่อไปนี้เป็นตารางที่แสดงถึงสายพันธ์ของเห็ดราที่สามารถสร้างสแตตินได้
| ชนิดของสแตติน | สายพันธ์ของเห็ดรา |
|---|---|
| เมวาสแตติน |
Penicillium citrinum |
| โลวาสแตติน |
Monascus rube |
| ปราวาสแตติน |
Aspergillus sp. |
สแตตินที่ได้จากผลิตภัณฑ์อาหาร
นอกจากโลวาสแตตินจะถูกสร้างได้จากเชื้อราบางสายพันธ์ดังแสดงในตารางดังข้างต้นแล้ว ยาดังกล่าวยังสามารถถูกสร้างได้จากเห็ดนางรม (Pleurotus ostreatus) ซี่งพบได้ทั่วไปในธรรมชาติและมีการผลิตเชิงอุตสาหกรรมเพื่อเป็นส่วนประกอบของอาหารหลายชนิด โดยเห็ดนางรมที่พบในธรรมชาตินั้นสามารถพบได้ทั่วไปแทบทุกส่วนของภาคพื้นทวีป ยกเว้นในแอนตาร์กติกา โดยมักพบเห็ดสายพันธ์ดังกล่าวขึ้นตามลำต้นของต้นไม้ที่ตายแล้ว นอกจากนั้นอาจพบขึ้นได้ตามกองฟางข้าว, ข้าวโพด, หรือธัญพืชชนิดอื่นๆ ได้ นอกเหนือจากนั้น การหมักข้าวแดงจากเชื้อราโมแนสคัส (Red Yeast Rice) ก็ถือเป็นอีกวิธีหนึ่งที่ใช้ในการสร้างโลวาสแตติน ซึ่งทำได้ดดยการหมักข้าวด้วยเชื้อราสายพันธ์ Monascus purpureus ซึ่งเป็นสายพันธ์ที่พบได้ตามธรรมชาติในอาหารพื้นเมืองของจีน เช่น เป็ดปักกิ่ง (Peking Duck) เป็นต้น
ประวัติการค้นพบ
การศึกษาค้นคว้าเกี่ยวกับโรคหลอดเลือดแข็ง

ในปี ค.ศ. 1575 นายแพทย์และนักกายวิภาคศาสตร์ชาวอิตาลีชื่อ Gabrielle Falloppio ค้นพบการเปลี่ยนแปลงพยาธิสภาพของหลอดเลือดเป็นครั้งแรก โดยพบการสะสมของหินปูนบริเวณผนังหลอดเลือด ซึ่งมีความสัมพันธ์กับการเกิดการเสื่อมสลายของกระดูก (bone degeneration) ส่วนการเกิดคราบพลัคเกาะบริเวณผนังหลอดเลือดนั้นได้ถูกอธิบายไว้เป็นครั้งแรกในช่วงศตวรรษที่ 17 โดยนักกายวิภาคศาสตร์ชาวสวิสเซอร์แลนด์ 2 คน ชื่อ Johann Conrad Brunner และ Albrecht von Haller และต่อมาในปี ค.ศ. 1799 Caleb Hillier Parry นายแพทย์ชาวอังกฤษพบว่าการเกิดโรคกล้ามเนื้อหัวใจขาดเลือด (ischemic heart disease) อาจมีความสัมพันธ์กับการเกิดโรคหลอดเลือดหัวใจแข็ง (coronary atherosclerosis) จากนั้นก็เริ่มมีการใช้ศัพท์ทางการแพทย์ว่า arteriosclerosis เพื่อใช้แทนความผิดปกติของหลอดเลือดในรูปแบบดังกล่าว ครั้งแรกในปี ค.ศ. 1835 โดยศัลยแพทย์ชาวฝรั่งเศส ชื่อ Jean Lobstein, ปี ค.ศ. 1904 โดย Felix Marchand พยาธิแพทย์ชาวเยอรมนี และต่อมาในปี ค.ศ. 1843 Julius Vogel แพทย์ชาวเยอรมนีได้ค้นพบว่าส่วนประกอบหลักของคราบหลักที่เกาะอยู่ตามผนังหลอดเลือดนั้นมักเป็นคอเลสเตอรอล ซึ่งบทบาทของคอเลสเตอรอลต่อการเกิดความผิดปกติของหลอดเลือดในรูปแบบดังกล่าวนั้นถูกค้นพบภายหลังในปี ค.ศ. 1852 และ 1856 โดย Karl von Rokitansky และ Rudolf Virchow ตามลำดับ ในปี ค.ศ. 1913 Nikolai Anichkov พยาธิแพทย์ชาวรัสเซีย ได้ทำการศึกษาถึงความความสัมพันธ์ระหว่างคอเลสเตอรอลกับการเกิดโรคหลอดเลือดแข็งในสัตว์ทดลองที่ได้รับการเหนี่ยวนำให้มีภาวะคอเลสเตอรอลในเลือดสูง ผลการทดลองพบว่าสัตว์ทดลองเหล่านั้นเกิดโรคหลอดเลือดแข็งดังเช่นสมมติฐานที่ตั้งไว้
ในการศึกษาวิจัยในประเด็นที่เชื่อกันว่า การเกิดโรคหลอดเลือดแข็งนั้นถือเป็นเรื่องปกติที่เกิดขึ้นได้จากการเสื่อมถอยตามธรรมชาติของร่างกายมนุษย์เมื่อมีอายุมากขึ้นและไม่มีวิธีการใดที่จะรบกวนการเกิดกระบวนการดังกล่าวได้นั้นยังคงไม่มีการศึกษาวิจัยเพิ่มเติม จนกระทั่งในช่วงต้นทศวรรษที่ 40 ในปี ค.ศ. 1949 John Gofman ได้ค้นพบไลโปโปรตีนคอเลสเตอรอลชนิดความเข้มข้นต่ำ (low-density lipoprotein; LDL) ในกระแสเลือด จากนั้นอีกไม่กี่ปีถัดมา Gofman ก็ได้ค้นพบความสัมพันธ์ระหว่างการมีระดับ LDL ในกระแสเลือดสูงกับการเกิดโรคหลอดเลือดหัวใจ (coronary heart disease) จากนั้นในปี ค.ศ. 1959 สถานบันวิจัยเซลล์ชีววิทยาและพันธุศาสตร์ระดับโมเลกุลมักซ์ พลังค์ (Max Planck Institute of Molecular Cell Biology and Genetics; MPI-CBG) ในเยอรมนีได้ค้นพบว่าเอนไซม์ HMG-CoA reductase นั้นเป็นเอนไซม์ที่มีบทบาทสำคัญในกระบวนการการสังเคราะห์คอเลสเตอรอลของร่างกายมนุษย์ และต่อมาในปี ค.ศ. 1961 จากการศึกษาวิจัยที่ตีพิมพ์ในวารสารทางการแพทย์ฉบับหนึ่งที่มีชื่อการศึกษาว่า Framingham study (Framingham Heart Study) ได้ค้นพบว่า การมีระดับคอเลสเตอรอลในกระแสเลือดที่สูงกว่าปกตินั้นถือเป็นอีกหนึ่งความเสี่ยงต่อการเกิดโรคหลอดเลือดหัวใจ (cardiovascular diseases) หลังจากนั้นไม่นาน เอกสารตีพิมพ์ของสมาคมโรคหัวใจแห่งสหรัฐอเมริกา (American Heart Association) ได้ยืนยันถึงความสัมพันธ์ดังกล่าวและให้คำแนะนำเกี่ยวกับการควบคุมอาหารในผู้ที่มีความเสี่ยงต่อการเกิดโรคหลอดเลือดหัวใจสูง อย่างไรก็ตาม ในช่วงทศวรรษที่ 60 ได้มีการค้นพบในประเด็นดังกล่าวเพิ่มเติมว่า ถึงแม้จะมีการควบคุมการรับประทานอาหารเป็นอย่างดี ร่างกายก็ยังสามารถสร้างคอเลสเตอรอลเพิ่มขึ้นได้ เพื่อให้เพียงพอต่อความต้องการของร่างกายได้โดยผ่านกระบวนการการเพิ่มการทำงานของเอนไซม์ที่ใช้สังเคราะห์คอเลสเตอรอลในตับ และในช่วงนั้น บทบาทของการใช้ยาลดระดับไขมันในกระแสเลือดเพื่อลดอัตราการเสียชีวิตและอัตราการเกิดความพิการจากโรคหลอดเลือดหัวใจนั้นยังสรุปได้ไม่แน่ชัดและยังคงเป็นเพียงการตั้งสมมติฐานที่ยังไม่มีการพิสูจน์ให้เห็นได้เด่นชัด จนกระทั่งในปี ค.ศ. 1984 การศึกษาวิจัยที่มีชื่อว่า LRC-CPPT ได้ค้นพบว่า การลดลงของระดับ LDL ในกระแสเลือดนั้นสามารถลดอัตราการเสียชีวิตและอัตราการเกิดความพิการจากโรคหลอดเลือดหัวใจในผู้ป่วยชายที่มีระดับ LDL ในกระแสเลือดสูงได้
การค้นพบยากลุ่มสแตติน
ในปี ค.ศ. 1973 เอริกะ เอ็นโดะ (Akira Endo) นักชีวเคมีชาวญี่ปุ่น ได้ทำการคัดแยกสารประกอบต่างๆ ที่ได้จากเชื้อจุลชีพมากกว่า 6,000 ชนิด โดยเฉพาะกลุ่มของเชื้อรา และพบว่าสารประกอบ ML-236B (เมวาสแตติน) ที่ถูกสร้างโดยเชื้อ Penicillium citrinum นั้นมีคุณสมบัติในการลดระดับคอเลสเตอรอลและ LDL ในกระแสเลือดทั้งในสัตว์ทดลองและในมนุษย์ แต่การศึกษาถึงผลของสารดังกล่าวในสัตว์ทดลองต่อมาในภายหลังพบว่ามีความเป็นพิษค่อนข้างสูง ในปี ค.ศ. 1976 นักวิทยาศาสตร์ชาวอังกฤษกลุ่มหนึ่งก็สามารถแยกสารประกอบที่มีชื่อว่า คอมเพคติน (Compactin) ได้จากสารเมทาบอไลต์ของเชื้อรา Penicillium brevicompactum ซึ่งต่อมาทราบว่าสารดังกล่าวนั้นเป็นสารชนิดเดียวกันกับเมวาสแตติน อย่างไรก็ตาม นักวิทยาศาสตร์กลุ่มดังกล่าวนั้นมุ่งเน้นศึกษาคุณสมบัติในการต้านเชื้อราของสารที่ค้นพบเป็นหลัก ไม่ได้มุ่งเน้นศึกษาฤทธิ์ในการยับยั้งเอนไซม์ HMG-CoA reductase แต่อย่างใด ต่อมาในปี ค.ศ. 1978 คณะศึกษาของ Alfred Alberts ได้ค้นพบสารชนิดหนึ่งที่มีโครงสร้างคล้ายคลึงกับสารประกอบ ML-236B ที่ได้จากกระบวนการการหมักของรา Aspergillus terreus ซึ่งต่อมาสารดังกล่าวถูกเรียกชื่อว่า Mevinolin และในช่วงเวลาเดียวกันนี้เอง เอริกะ เอ็นโดะ ก็สามารถคัดแยกสารประกอบที่มีชื่อว่า Monacolin K ซึ่งมีกลไกออกฤทธิ์คล้ายคลึงกับสแตติน ได้จากรา Monascus ruber จากนั้นในปี 1979 เอ็นโดะก็ได้รับสิทธิบัตรในการผลิตสารดังกล่าว และในช่วงปลายปีนั้น ก็ได้มีการค้นพบว่า โดยที่จริงแล้ว Monacolin K และ Mevinolin นั้นเป็นสารประกอบชนิดเดียวกัน ซึ่งเป็นที่รู้จักกันดีในปัจจุบันภายใต้ชื่อว่า โลวาสแตติน
การพัฒนายากลุ่มสแตติน
ในปี ค.ศ. 1987 ได้มีการผลิต โลวาสแตติน เพื่อจำหน่ายเชิงการค้าเป็นครั้งแรก ภายใต้ชื่อการค้า Mevacor ของบริษัท Merck & Co. (หรือ Merck Sharp & Dohme, MSD สำหรับในประเทศอื่นนอกเหนือจากสหรัฐอเมริกาและแคนาดา) ซึ่งสแตตินชนิดแรกที่ถูกผลิตขึ้นในเชิงอุตสาหกรรมการค้า และต่อมาไม่นานนัก บริษัท ไดอิจิ ซังเคียว (Daiichi Sankyo) ซึ่งเป็นผู้ค้นพบเมวาสแตติน ได้พัฒนาสแตตินชนิดใหม่ซึ่งเป็นอนุพันธ์ของเมวาสแตตินขึ้นมา มีชื่อว่า ปราวาสแตติน ซึ่งมีความแรงและความจำเพาะในการออกฤทธิ์มากกว่าสารต้นแบบเดิม และถูกนำออกจำหน่ายในญี่ปุ่นภายใต้ชื่อการค้า Mevalotin ในปี ค.ศ. 1988 และปี ค.ศ. 1991 ในสหรัฐอเมริกา ภายใต้ชื่อการค้า Pravachol และจากนั้นอีก 2 เดือนถัดมา ซิมวาสแตติน ภายใต้ชื่อการค้า Zocor ก็ถูกผลิตออกวางจำหน่ายในท้องตลาด ส่วนสแตตินที่ได้จากการสังเคราะห์ชนิดแรกที่ถูกผลิตออกจำหน่ายเชิงการค้า คือ ฟลูวาสแตติน (ชื่อการค้า Lescol) ของบริษัท โนวาร์ติส (Novartis) ในช่วงปี ค.ศ. 1993 และอีก 3 ปีถัดมา บริษัทไฟเซอร์ (Pfizer) ก็ได้ผลิตสแตตินสังเคราะห์อีกชนิดหนึ่งออกจำหน่ายในท้องตลาด คือ อะโทวาสแตติน ภายใต้ชื่อการค้า Lipitor หลังจากนั้นมาเพียงแค่อีก 1 ปี บริษัท เบเยอ่ร์เอจี (Bayer AG) ก็ได้ผลิตสแตตินสังเคราะห์อีกชนิด คือ เซอริวาสแตติน ออกจำหน่ายในท้องตลาด ภายใต้ชื่อการค้า Baycol และ Lipobay ซึ่งต่อมาในวันที่ 8 สิงหาคม ค.ศ. 2001 ตัวยาดังกล่าวถูกถอนทะเบียนออกจากตลาดโดยความสมัครใจของบริษัท (ภายใต้ความเห็นชอบของคณะกรรมการอาหารและยาของสหรัฐอเมริกา) เนื่องจากการใช้ยาดังกล่าวนั้นเพิ่มความเสี่ยงต่อการเกิดอาการข้างเคียงที่รุนแรงคือ การเกิดภาวะกล้ามเนื้อสลายแบบ rhabdomyolysis จากนั้น ในปี ค.ศ. 2000 บริษัท โนวาร์ติส (Novartis) ได้มีการวางจำหน่ายยากลุ่มสแตตินชนิดใหม่ คือ ฟลูวาสแตติน ภายใต้ชื่อการค้า Lescol XL และถัดจากนั้นมาอีกแค่ 3 ปี บริษัทโควะ ฟาร์มาซูตคอลส์ (Kowa Pharmaceuticals) ก็ได้มีการผลิตสแตตินตัวใหม่อีก 2 ชนิด ออกจำหน่ายในท้องตลาด คือ พิทาวาสแตติน ภายใต้ชื่อการค้า Livalo และโรสุวาสแตติน ภายใต้ชื่อการค้า Crestor และ AstraZeneca
การศึกษาทางคลินิก
จากข้อมูลการศึกษาทางคลินิกหลายการศึกษาที่มีในปัจจุบันให้ผลสนับสนุนข้อเท็จจริงที่ว่าการใช้ยากลุ่มสแตตินมีผลลดอุบัติการณ์การเกิดโรคหลอดเลือดหัวใจในผู้ที่มีความเสี่ยงต่อการเกิดโรคดังกล่าวสูง ซึ่งรวมไปถึงการลดอัตราการเสียชีวิตจากการเกิดความผิดปกติดังกล่าวด้วย การศึกษาที่สำคัญที่ให้ข้อมูลยืนยันถึงประสิทธิภาพของสแตตินในการเป็นยาป้องกันปฐมภูมิ (primary prevention) ต่อการเกิดโรคหลอดเลือดหัวใจ ได้แก่ การศึกษา WOSCOPS, AFCAPS / TEXCAPS, HPS และ JUPITER ส่วนการศึกษาที่ให้ข้อมูลยืนยันถึงประสิทธิภาพของสแตตินในการเป็นยาป้องกันทุติยภูมิ (secondary prevention) ต่อการเกิดโรคหลอดเลือดหัวใจ ได้แก่ การศึกษา 4S, LIPID และ CARE และการศึกษาที่ให้ผลสนับสนุนถึงประสิทธิภาพของการใช้สแตตินร่วมกับยาลดไขมันในกระแสเลือดชนิดอื่น ได้แก่ การศึกษา ACCORD study และ LIPID SHARP ซึ่งรายละเอียดของแต่ละการศึกษาดังแสดงในตารางต่อไปนี้
| ชื่อย่อ การศึกษา |
ชื่อ การศึกษา |
ระยะเวลา ศึกษา |
ยาที่ใช้ ในการศึกษา |
กลุ่มตัวอย่าง | วารสาร ที่ตีพิมพ์ |
จำนวน กลุ่มตัวอย่าง |
ผลการศึกษา |
| 4S |
Scandinavian Simvastatin Survival Study |
5 ปี | ซิมวาสแตติน |
|
Lancet | 4444 |
|
| LIPID |
Long term Intervention with Pravastatin in Ischemic Disease |
6 ปี | ปราวาสแตติน |
|
NEJM | 9014 |
|
| CARE |
Cholesterol And Recurrent Events |
5 ปี | ปราวาสแตติน |
|
NEJM | 4159 |
|
| WOSCOPS |
West Of Scotland Coronary Prevention Study |
5 ปี | ปราวาสแตติน |
|
NEJM | 6595 |
|
| TEXCAPS |
Air Force/Texas Coronary Atherosclerosis Prevention Study |
5 ปี | โลวาสแตติน |
|
American Journal of Cardiology |
6605 |
|
| HPS |
Heart Protection Study of cholesterol lowering with simvastatin |
5 ปี | ซิมวาสแตติน |
|
Lancet | 20,536 |
|
| JUPITER |
Justification for the Use of Statins in Primary Prevention: An Intervention Trial Evaluating Rosuvastatin trial |
2 ปี | โรสุวาสแตติน |
|
NEJM | 17,802 |
|
| ACCORD LIPID |
Action to Control Cardiovascular Risk in Diabetes Lipid Trial |
5 ปี | ซิมวาสแตติน ฟีโนไฟเบรต |
|
NEJM | 5518 |
|
| SHARP |
Study of Heart and Renal Protection |
5 ปี | ซิมวาสแตติน อีเซทิไมบ์ |
|
Lancet | 9270 |
|
โครงสร้าง
โครงสร้างหลักของสแตตินที่ได้จากธรรมชาติ (โลวาสแตติน, ปราวาสแตติน, ซิมวาสแตติน, รวมไปถึงเมวาสแตตินที่ยังไม่มีการนำมาใช้ในทางคลินิก) จะมีโครงสร้างเป็น hydrogenated naphthalene ที่ประกอบไปด้วยคาร์บอนจำนวน 7 อะตอม มีหมู่เมธิลที่ตำแหน่งที่ 7, หมู่ไฮดรอกซิลในตำแหน่งที่ 4 (สำหรับปราวาสแตตินและ active form ของโลวาสแตติน, ซิมวาสแตติน, และแมวาสแตติน จะถูกเปลี่ยนแปลงโดยปฏิกิริยาไฮโดรไลสิสได้เป็น β-hydroxy carboxylic acid) ส่วนโครงสร้างหลักของสแตตินที่ได้จากการสังเคราะห์ ได้แก่ อะโทวาสแตตินมีโครงสร้างหลักเป็นวงไพร์โรล (pyrrole), ฟลูวาสแตตินมีโครงสร้างหลักเป็นวงอินโดล (indole), เซอริวาสแตตินมีโครงสร้างหลักเป็นวงไพริดีน (pyridine), โรสุวาสแตตินมีโครงสร้างหลักเป็นวงไพริมิดีน (pyrimidine) และปราวาสแตตินมีโครงสร้างเป็นวงควิโนโลน (quinolone) ทั้งนี้ นอกจากโครงสร้างของสแตตินทุกชนิดจะมีความคล้ายคลึงกันกับโมเลกุลของ 3-hydroxy-3-methylglutaryl-coenzyme A (HMG- CoA) แล้ว ยังมีความจำเพาะในการจับกับเอนไซม์ 3-hydroxy-3-methylglutaryl-coenzyme A (HMG-CoA) reductase ได้มากกว่า HMG-CoA ถึง 1000 เท่า ซึ่งเมื่อมีการเกิดสารประกอบเชิงซ้อนระหว่างเอนไซม์ดังกล่าวกับยากลุ่มสแตตินแล้วจะเกิดการจับกันอย่างสมบูรณ์แต่ก็สามารถเกิดการผันกลับได้ (competitively and reversibly)
การจับกับเอนไซม์ของสแตติน
จากข้อมูลที่ได้จากการศึกษาวิจัยพบความสัมพันธ์ระหว่างโครงสร้างของสแตตินกับรูปแบบในการจับกับเอนไซม์ HMG-CoA reductase ดังต่อไปนี้
- โครงสร้างหลัก (pharmacophore) ที่เป็น 3,5-dihydroxyhept-6-enoic acid ซึ่งมีหมู่ไฮดรอกซิลที่ตำแหน่งที่ 3 และ 5 เป็นโครงสร้างสำคัญที่ใช้จับเอนไซม์ HMG-CoA reductase
- วงแหวนแลคโตนของโลวาสแตตินและซิมวาสแตตินจะเกิดปฏิกิริยาไฮโดรไลสิสและได้ผลิตภัณฑ์สุดท้ายเป็นตัวยาในรูปแบบที่ออกฤทธิ์ได้ (active form)
- ระยะห่างที่เหมาะสมที่สุดระหว่างหมู่แทนที่และวงแหวน C5 คือ 2 อะตอม
- วง decahydronaphthalene (Decalin) ของโลวาสแตติน, ซิมวาสแตติน และปราวาสสแตตินควรเป็นวง heterocyclic ring ที่มีคาร์บอน 5-6 อะตอม
- พันธะระหว่าง C6 และ C7 ในวง Decalin และหมู่แทนที่ของวงไพรอลของโวาสแตติน, ซิมวาสแตติน และอะโทวาสแตติน ควรที่จะเป็นพันธะเดี่ยว ส่วนสแตตินชนิดอื่นควรจะเป็นพันธะคู่
- หมู่แทนที่ p-fluorophenyl และสายแอลิฟาติกที่ตำแหน่ง ortho ของโครงสร้างหลักของสแตตินที่เป็นสารประกอบเฮเทอโรไซคลิกจะเพิ่มความสามารถในการจับกับ HMG-CoA reductase
กลไกการออกฤทธิ์
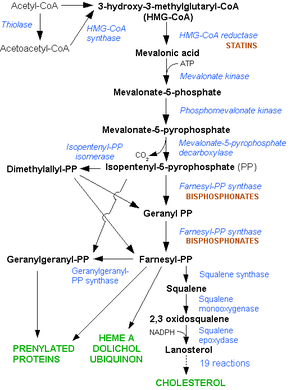
กระบวนการสังเคราะห์คอเลสเตอรอลในมนุษย์นั้นต้องผ่านขั้นตอนต่างๆ หลายขั้นตอน โดยขั้นตอนแรก คือ การสร้าง mevalonate โดยการรีดิวซ์ 3-hydroxy-3-methylglutaryl-coenzyme A (HMG-CoA) ซึ่งในขั้นตอนนี้จำเป็นต้องใช้เอนไซม์ HMG-CoA reductase ในiรูปแบบที่ถูกรีดิวซ์ (reduced form) ของ nicotinamide adenine dinucleotide phosphate (NADPH + H +) ในการเกิดปฏิกิริยา ซึ่ง mevalonate ที่เกิดขึ้นนี้จะถูกเปลี่ยนแปลงโดยเอนไซม์ต่างๆในร่างกายอีกหลายขั้นตอนจนเกิดเป็นคอเลสเตอรอลในที่สุดสแตตินออกฤทธ์ยับยั้งเอนไซม์ ซึ่งกระบวนการนี้จะเกิดขึ้นที่ตับ และคอเลสเตอรอลที่ผลิตได้คิดเป็นร้อยละ 70 ของคอเลสเตอรอลภายในร่างกายทั้งหมด โดยการทำงานของเอนไซม์ HMG-CoA reductase นี้จะถูกยับยั้งได้โดยปริมาณน้ำดีในร่างกาย, ระดับ mevalonate และระดับคอเลสเตอรอลในร่างกายเท่านั้น ดังนั้นจึงอาจถือได้ว่าเอนไซม์ HMG-CoA reductase ถือเป็นเอนไซม์ที่สำคัญในกระบวนการการสร้างคอเลสเตอรอลในมุนษย์ การยับยั้งการทำงานของเอนไซม์นี้จะมีผลลดระดับคอเลสเตอรอลในกระแสเลือดลงได้
การรออกฤทธิ์ของสแตตินแต่ละชนิดนั้นจะมีความจำเพาะแตกต่างกันไปในแง่ของความสามารถในการเข้าจับกับเอนไซม์หรือระยะเวลาที่จับกับเอนไซม์ ซึ่งจะเกิดขึ้นได้โดยทันทีเมื่อยาเข้าสู่ภายในเซลล์ตับ การยับยั้งการสร้างคอเลสเตรอลจะส่งผลให้เกิดการลดลงระดับคอเลสเตอรอลในกระแสเลือด ทำให้ร่างกายขาดแคลนคอเลสเตอรอล เป็นผลให้รบกวนทำงานของยีนหลายยีนในร่างกาย โดยเฉพาะอย่างยิ่ง SREBP ซึ่งเป็นโปรตีนที่ถูกสร้างมาจากยีนที่ทำหน้าที่ควบคุมการสร้างจำพวกสเตอรอล โดยการรบกวนการทำงานของยีนนี้จะทำให้เกิดสร้างตัวรับ LDL ที่ผิวเซลล์ตับให้มีจำนวนเพิ่มขึ้น และผลจากการที่มีตัวรับ LDL เพิ่มขึ้นนี้จะทำให้ LDL ถูกเก็บเข้าสู่เซลล์ตับมากขึ้น เป็นผลให้ระดับ LDL ในกระแสเลือดลดลงได้ในที่สุด โดยผลที่เกิดขึ้นจากกระบวนการเหล่านี้จะเห็นผลได้ชัดเจนภายหลัง 2 สัปดาห์แรกของการใช้ยา และจะเห็นผลได้อย่างเต็มที่หลังจากการรับประทานยาครั้งแรก 6 สัปดาห์
ผลไพลโอโทรปิคของสแตติน
กลไกพื้นฐานของสแตตินที่ก่อให้เกิดผลด้านไพลโอโทรปิคของสแตตินคือ การยับยั้งการทำงานของเอนไซม์ 3-hydroxy-3-methylglutaryl-coenzyme A (HMG-CoA) reductase ทำให้มีสร้างสารกลุ่ม isoprenoids ลดน้อยลง ซึ่งจะส่งผลดีต่อพยาธิสภาพของหลอดเลือด โดยจะลดการเกิดการทำลายเซลล์ผนังหลอดเลือดโดยอนุมูลอิสระ (oxidative stress) และลดการเกิดคราบพลัคบริเวณผนังหลอดเลือด ซึ่งคราบพลัคที่เกิดขึ้นเหล่านี้อาจทำให้เกิดการอุดกั้นของเส้นเลือด หรืออาจเหนี่ยวนำให้เกิดการอักเสบและมีผลยับยั้งการซ่อมแซมเส้นเลือดที่สึกหรอได้ ตารางต่อไปนี้ เป็นตารางเปรียบเทียบผลไพลโอโทรปิคของสแตตินชนิดต่างๆ
|
|
|||||||||
| เกล็ดเลือด | ยับยั้งการกระตุ้นเกล็ดเลือด | + | – | + | – | + | – | + | – |
| ห้ามการจับกันของเกล็ดเลือด | – | – | + | – | + | – | – | – | |
| เยื่อบุหลอดเลือด | กระตุ้นหรือเพิ่มการสังเคราะห์ไนตริกออกไซด์ | – | – | – | + | + | – | – | + |
| ยับยั้งการสร้างอนุมูลอิสระ | – | – | + | – | + | – | + | + | |
| เพิ่มจำนวนหรือการทำงานของเซลล์ต้นกำเนิดผนังหลอดเลือด | + | – | – | – | – | – | – | + | |
| เซลล์กล้ามเนื้อเรียบของหลอดเลือด | ลดการเพิ่มจำนวนเซลล์ | – | – | – | – | + | – | + | + |
| ลดการเกิด migration | – | – | – | – | – | – | + | + | |
| เพิ่มการเกิดอะพอพโทซิส | + | + | + | + | + | – | – | – | |
| แมคโครฟาจ/โมโนไซต์ | ลดการเพิ่มจำนวนเซลล์ | – | – | – | – | – | – | – | – |
| ลดการทำงานของเอนไซม์ MNP protease | – | + | – | – | – | + | + | + | |
| ลดการเกิดoxidized LDL | – | – | – | + | + | – | + | + | |
| Vasculitis | ลดการทำงานของ MHC-II | + | – | – | + | + | + | + | + |
| ลดระดับ hs-CRP | – | – | – | + | + | + | + | + |
ยาในกลุ่มสแตติน
ยาเดี่ยว
ในปี ค.ศ. 2014 มียากลุ่มสแตตินที่ถูกวางจำหน่ายในม้องตลาดอยู่ทั้งสิ้น 8 ชนิด ได้แก่ อะโทวาสแตติน, ฟลูวาสแตติน, โลวาสแตติน, ปราวาสแตติน, โรสุวาสแตติน, ซิมวาสแตติน, พิทาวาสแตติน, พิทาวาสแตติน และเมวาสแตติน ส่วนเซอริวาสแตตินนั้นถูกถอนทะเบียนออกจากตลาดในปี ค.ศ. 2001 เนื่องจากการใช้ยาดังกล่าวจะเพิ่มความเสี่ยงต่อการเกิดภาวะกล้ามเนื้อสลายแบบ rhabdomyolysis เป็นอย่างมาก จากความแตกต่างทางเคมีและเภสัชพลนศาสตร์ของสแตตินแต่ละชนิดทำให้สามารถแยกสแตตินชนิดต่างๆ ออกไปเป็น 4 รุ่น ได้แก่
- รุ่นที่ 1 เมวาสแตติน, โลวาสแตติน และปราวาสแตติน
- รุ่นที่ 2 ซิมวาสแตติน
- รุ่นที่ 3 ฟลูวาสแตติน
- รุ่นที่ 4 อะโทวาสแตติน, เซอริวาสแตติน, โรสุวาสแตติน และพิทาวาสแตติน
ตารางต่อไปนี้เป็นตารางแสดงสูตรโครงสร้างของสแตตินชนิดต่างๆ ที่ถูกค้นพบตั้งแต่อดีตจนถึงปัจจุบัน
| อะโทวาสแตติน | เซอริวาสแตติน | ฟลูวาสแตติน | โลวาสแตติน | เมวาสแตติน |
|---|---|---|---|---|
| C33H34FN2O5 | C26H34FNO5 | C24H26FNO4 | C24H36O5 | C23H34O5 |

|

|

|

|

|
| พิทาวาสแตติน | ปราวาสแตติน | โรสุวาสแตติน | ซิมวาสแตติน | |
| C25H24FNO4 | C23H36O7 | C22H28FN3O6S | C25H38O5 | |

|

|

|

|
ยาสูตรผสม
ยากลุ่มสแตตินเป็นยาที่มีการสั่งใช้เป็นจำนวนมาก เนื่องจากในปัจจุบันประชากรโลกมีแนวโน้มที่จะเกิดความผิดปกติของระดับไขมันในเลือดเพิ่มมากขึ้น ซึ่งถือเป็นความเสี่ยงที่สำคัญอีกอย่างหนึ่งต่อการเกิดโรคหลอดเลือดหัวใจและโรคหลอดเลือดสมอง โดยพบว่ากว่าร้อยละ 50 และ 35 ของประชากรในประเทศที่มีรายได้สูงมีความเสี่ยงต่อการเกิดโรคหลอดเลือดหัวใจและหลอดเลือดสมองตามลำดับ ในขณะที่ในประเทศที่มีรายได้ปานกลาง-น้อยก็จะมีสัดส่วนของประชากรที่มีความเสี่ยงดังกล่าวลดลงมาตามลำดับ ดังนั้น การใช้ยากลุ่มสแตตินในผู้ป่วยที่มีภาวะไขมันในเลือดสูงหลายชนิดในรูปแบบยาสูตรผสมร่วมกับยาลดไขมันในกระแสเลือดชนิดอื่น หรือการใช้สแตตินผสมกับยารักษาโรคเรื้อรังอื่นในผู้ที่มีโรคร่วม จึงถือเป็นอีกทางเลือกหนึ่งที่จะสามารถลดค่าใช้จ่ายและงบประมาณในการดูแลสุขภาวะทางสุขภาพของประชากรเหล่านั้นได้ นอกจากนี้แล้ว การใช้ยาในรูปแบบสูตรผสมยังเป็นผลให้ผู้ป่วยเหล่านั้นรับประทานยาง่ายขึ้น ไม่จำเป็นต้องรับประทานยาหลายหน่วยพร้อมกัน โดยที่ประสิทธิภาพในการรักษาของยาแต่ละชนิดในยาสูตรผสมนั้นไม่แตกต่างไปจากเดิม จึงถือเป็นการเพิ่มความร่วมมือในการใช้ยาของผู้ป่วยทางหนึ่ง โดยยาสูตรผสมของสแตตินที่มีจำหน่ายในท้องตลาดปัจจุบัน ดังแสดงในตารางต่อไปนี้
ตาราง 1 แสดงยาสูตรผสมที่มีขนาดของสแตตินหลายขนาด
| สแตติน | แอมโลดิปีน | อีเซทิไมบ์ | ไนอะซิน | ฟีโนไฟเบรต | แอสไพริน | แอสไพริน รามิพริล |
ซิทากลิปทิน |
| อะโทวาสแตติน |
|
|
|||||
|---|---|---|---|---|---|---|---|
| เซอริวาสแตติน | |||||||
| ฟลูวาสแตติน | |||||||
| โลวาสแตติน |
|
||||||
| พิทาวาสแตติน | |||||||
| ปราวาสแตติน |
|
|
|||||
| โรสุวาสแตติน |
|
|
|||||
| ซิมวาสแตติน |
|
|
|
|
|
ตารางที่ 2 แสดงยาสูตรผสมที่มีขนาดของสแตตินขนาดเดียว (fixed dose)
| สแตติน | แอสไพริน | อะทีโนลอล | อีนาลาพริล | ไฮโดรคลอไรไทอะไซด์ | ริสิโนพริล | เมโทโพรลอล | รามิพริล | วอลซาร์ทาน |
| อะโทวาสแตติน |
|
|
|
|||||
|---|---|---|---|---|---|---|---|---|
|
|
|
|||||||
|
|
|
|
||||||
|
|
|
|
||||||
|
|
|
|||||||
| ซิมวาสแตติน |
|
|
|
|||||
|
|
|
|
||||||
|
|
|
|
คุณสมบัติ
คุณสมบัติทางกายภาพ
ตารางต่อไปนี้เป็นตารางแสดงคุณสมบัติทางกายภาพ และตารางแสดงค่าการละลายของสแตตินชนิดต่างๆ ตามลำดับ
| คุณสมบัติ | อะโทวาสแตติน | เซอริวาสแตติน | ฟลูวาสแตติน | โลวาสแตติน | พิทาวาสแตติน | ปราวาสแตติน | โรสุวาสแตติน | ซิมวาสแตติน |
| มวลโมลาร์ | 557.63 |
|
411.46 | 404.53 | 421.46 | 424.52 | 481.53 | 418.56 |
|---|---|---|---|---|---|---|---|---|
| ลักษณะภายนอก | ผงสีขาวหรือเทาขาว | ผงผลึกสีขาวหรือเทาขาว, เหลืองอ่อนไปจนถึงแดงอ่อน ดูดความชื้นได้ดีมาก | ผงผลึกสีขาวหรือเกือบขาว | ผงสีขาวหรือเหลืองอ่อน | ผงหรือผลึกผงสีขาวถึงเหลืองอ่อน ดูดความชื้นได้ดี | ผงสีขาว | ผงผลึกสีขาวหรือเกือบขาว | |
| จุดหลอมเหลว [°C] | 159.2-160.7 |
|
194-197 | 174.5 | 171-174 | 171.2-173 | 151-156 | 135-138 |
| logP | 5.7 |
|
4.5 | 4.26 | 3.75 | 0.59 | 0.13 | 4.68 |
| ค่าการละลายในตัวทำละลายชนิดต่างๆ (mg/ml) | ||||||||
| น้ำ | 1.23 |
|
0.00046 | 0.0004 | 0.00394 | 19.0 | 0.0886 | 0.0122 |
| อะซิโตน | 47.0 | |||||||
| อาซีโตไนไตรล์ | 28.0 | |||||||
| เอ็น-บิวทานอล | 7.0 | |||||||
| ไอโซบิวทานอล | 14.0 | |||||||
| คลอโรฟอร์ม | 350.0 | |||||||
| DMF | 15.0 | 10.0 | 90.0 | 30.0 | 30.0 | 5.0 | 20.0 | |
| DMSO | 15.0 | 10.0 | 25.0 | 30.0 | 5.0 | 20.0 | ||
| เอทานอล | 0.5 | 0.5 | 16.0 | 30.0 | 1.0 | 20.0 | ||
| เมทานอล | 28.0 | |||||||
| เอ็น-ออคทานอล | 2.0 | |||||||
| เอ็น-โพรพานอล | 11.0 | |||||||
| ไอโซโพรพานอล | 20.0 | |||||||
คุณสมบัติทางเคมี
เมื่อสแตตินสัมผัสกับแสงแดดหรือแสงรังสีจากแหล่งสร้างแสงอื่นที่มีคุณสมบัติคล้ายคลึงกับแสงแดด พบว่าไม่เกิดปฏิกิริยาการเสื่อมสลายของตัวยา ถึงแม้ว่าจะมีการเกิดปฏิกิริยาไฮโดรไลสิสที่บริเวณวงแหวนแลคโตนของโครงสร้างหลัก แต่ปฏิกิริยาดังกล่าวนั้นสามารถผันกลับได้ จากการทดลองในห้องปฏิบัติการพบว่า การฉายรังสีอุลตร้าไวโอเลตความยาวคลื่น 254 นาโนเมตรไปยังสแตติน พบว่าสามารถเหนี่ยวนำให้เกิดการสลายตัวของสแตตินได้อย่างช้าๆ
ส่วนการตกค้างของยากลุ่มสแตตินในสิ่งแวดล้อมนั้น พบการเกิดการตกค้างได้น้อยมาก เนื่องจากยากลุ่มดังกล่าวโดยส่วนใหญ่มักถูกขับออกจากร่างกายในรูปแบบของสารเมทาบอไลต์โดยมีรายงานการพบอะโทวาสแตตินในสิ่งปฏิกูลและน้ำในแม่น้ำ ปกติแล้ว สแตตินเมื่ออยู่ในตัวกลางที่เป็นสารละลายภายใต้สภาพแวดล้อมที่ต้องสัมผัสกับแสงอาทิตย์และอุณหภูมิสูงจะเกิดการสลายตัวไปเป็นรูปแบบที่ไม่สามารถออกฤทธิ์ได้ จนเกิดการสลายตัวของสารได้ในที่สุด ส่วนในสภาวะที่ไม่มีแสงและอยู่ในแก๊สเฉื่อย ยากลุ่มสแตตินจะเกิดปฏิกิริยาไฮโดรไลสิสได้อย่างช้าๆ โดยปฏิกิริยาการสลายตัวนี้จะเพิ่มอัตราเร็วขึ้นจนถึงระดับที่มีนัยสำคัญทางสถิติในสภาวะที่เป็นด่าง
ประสิทธิภาพในการรักษา
เมื่อเปรียบเทียบประสิทธิภาพในการลดระดับ LDL ของสแตตินชนิดต่างๆ พบว่าเซอริวาสแตติน มีความแรงในการลดระดับ LDL ได้มากที่สุด รองลงมาเป็น โรสุวาสแตติน, อะโทวาสแตติน, ซิมวาสแตติน, โลวาสแตติน, ปราวาสแตติน และ ฟลูวาสแตติน ตามลำดับ ส่วนพิทาวาสแตตินนั้นยังไม่มีการศึกษามากพอที่จะยืนยันถึงประสิทธิภาพได้เด่นชัด ตารางต่อไปนี้เป็นตารางที่แสดงถึงประสิทธิภาพในการลดระดับคอเลสเตอรอลในกระแสเลือดของสแตตินชนิดต่างๆ ในขนาดที่ต่างกัน
| Statin equivalent dosages | ||||||
|---|---|---|---|---|---|---|
| % LDL ที่ลดลง (ประมาณ) | อะโทวาสแตติน | ฟลูวาสแตติน | โลวาสแตติน | ปราวาสแตติน | โรสุวาสแตติน | ซิมวาสแตติน |
|
|
||||||
|
|
||||||
|
|
||||||
|
|
||||||
| 46–50% | 40 mg | – | – | – | 10–20 mg | 80 mg* |
| 50–55% | 80 mg | – | – | – | 20 mg | – |
| 56–60% | – | – | – | – | 40 mg | – |
| * ไม่แนะนำให้ใช้ในขนาด 80-mg dose เนื่องจากจะเพิ่มความเสี่ยงต่อการเกิดภาวะกล้ามเนื้อสลายแบบ rhabdomyolysis | ||||||
| ขนาดยาเริ่มต้น | ||||||
| ขนาดยาเริ่มต้น | 10–20 mg | 20 mg | 10–20 mg | 40 mg | 10 mg; 5 mg สำหรับผู้ที่มีภาวะ พร่องไทรอยด์ฮอร์โมน, อายุ >65 ปี, ชาวเอเชีย |
20 mg |
| กรณีต้องการลด LDL เป็นจำนวนมาก | 40 mg ถ้าต้องการลด >45% | 40 mg ถ้าต้องการลด>25% | 20 mg ถ้าต้องการลด >20% | -- | 20 mg ถ้า LDL >190 mg/dL (4.87 mmol/L) | 40 mg ถ้าต้องการลด >45% |
| เวลาที่เหมาะสมในการรับประทานยา | ไม่จำกัด | ตอนเย็น | พร้อมอาหารเช้า | ไม่จำกัด | ไม่จำกัด | ตอนเย็น |
กราฟต่อไปนี้แสดงประสิทธิภาพในการลดระดับไลโปโปรตีนคอเลสเตอรอลชนิดความหนาแน่นต่ำ (แสดงด้วยเส้นกราฟสีฟ้า), ระดับคอเลสเตอรอลรวม (แสดงด้วยเส้นกราฟสีน้ำตาล) และระดับไตรกลีเซอรได์ (แสดงด้วยเส้นกราฟสีเขียว)ในกระแสเลือดของยากลุ่มสแตตินแต่ละชนิดในขนาดความแรงต่างๆ โดยเปรียบเทียบกับค่าพื้นฐานที่ยังไม่ได้รับการรักษาด้วยยา
|
|
|
|
กราฟต่อไปนี้แสดงประสิทธิภาพในการเพิ่มระดับไลโปโปรตีนคอเลสเตอรอลชนิดความหนาแน่นสูง (HDL cholesterol) ในกระแสเลือดของยากลุ่มสแตตินแต่ละชนิดในขนาดความแรงต่างๆ โดยเปรียบเทียบกับค่าพื้นฐานที่ยังไม่ได้รับการรักษาด้วยยา
|
|
|
|
เภสัชจลนศาสตร์
ค่าชีวปริมาณออกฤทธิ์ (bioavailability)ของสแตตินนั้นมีค่าแตกต่างกันออกไป โดยมีค่าอยู่ระหว่าง 5-80% ซึ่งค่านี้จะมีความสัมพันธ์กันกับการเกิดเฟิร์สท-พาสส์ เมตาโบลิซึม (first-pass metabolism) และการสะสมของสแตตินในเซลล์ตับ ส่วนความสามารถในการกระจายตัวไปยังเนื้อเยื่อต่างๆของร่างกายนั้นจะขึ้นอยู่กับความสามารถในการละลายในไขมันของสแตตินแต่ละชนิด โดยอะโทวาสแตติน, เซอริวาสแตติน, โลวาสแตติน, และซิมวาสแตตินจัดว่าเป็นสแตตินที่ละลายในไขมันได้ดี ส่วนสแตตินชนิดอื่นๆ ได้แก่ ฟลูวาสแตติน,โรสุวาสแตติน, พิทาวาสแตติน และปราวาสแตตินนั้นถือเป็นสแตตินที่ละลายในน้ำ ส่วนสัดส่วนการถูกดูดซึมโดยลำไส้เล็กของสแตตินนั้นจะอยู่ระหว่าง 30-50% ของขนาดที่รับประทาน ตารางต่อไปนี้เป็นตารางเปรียบเทียบค่าพารามิเตอร์ทางเภสัชจลนศาสตร์ต่างๆ ของสแตตินแต่ละชนิด
| ค่าพารามิเตอร์ | อะโทวาสแตติน | เซอริวาสแตติน | ฟลูวาสแตติน | โลวาสแตติน | พิทาวาสแตติน | ปราวาสแตติน | โรสุวาสแตติน | ซิมวาสแตติน |
|
โปรดรัก (prodrug) |
ไม่ใช่ |
|
ไม่ใช่ | ใช่ | ไม่ใช่ | ไม่ใช่ | ไม่ใช่ | ใช่ |
|---|---|---|---|---|---|---|---|---|
| Active metabolite |
ใช่ |
|
ไม่ใช่ | ใช่ | เล็กน้อย | ไม่ใช่ | เล็กน้อย | ใช่ |
| ปริมาณชีวอนุเคราะห์[%] | 12 |
|
19-29 | 5 | 80 | 18 | 20 | 5 |
| เวลารับประทาน ที่เหมาะสม |
ตอนเย็น |
|
ตอนเย็น | ตอนเช้า หรือ ตอนเย็น และพร้อมอาหาร |
ตอนเย็น | ตอนเย็น | ตอนเช้า หรือ ตอนเย็น |
ตอนเย็น |
| ชีวปริมาณออกฤทธิ์ [%] | 98 |
|
>99 | >95 | 96 | 43-55 | 90 | 95-98 |
| ผลของอาหารต่อ ชีวปริมาณออกฤทธิ์ |
ไม่มีผล |
|
ไม่มีผล | เพิ่ม | ไม่มีผล | เพิ่ม | ไม่มีผล | ไม่มีผล |
| ค่าครึ่งชีวิต[h] | 15-30 |
|
0.5-2.3 | 2-4 | 11 | 1.3-2.8 | 19 | 2-3 |
| ระยะเวลาที่ระดับ ยาในเลือดขึ้นสูงสุด [h] |
2-3 |
|
0.5-1 | 2-4 | 11 | 1.3-2.8 | 19 | 2-3 |
| ระดับยาเฉลี่ย ในเลือดสูงสุด [ng/ml] |
27-66 |
|
448 | 10-20 | 20 | 45-55 | 37 | 10-34 |
| ความชอบไขมัน | ใช่ |
|
ไม่ใช่ | ใช่ | ใช่ | ไม่ใช่ | ไม่ใช่ | ใช่ |
| สัดส่วนที่ขับออก ทางไต [%] |
2 |
|
6 | 10 | <2 | 20 | 10 | 13 |
| การเปลี่ยนแปลง ที่ตับ |
CYP3A4 |
CYP2C8 |
CYP2C9 | CYP3A4 | CYP2C9 | sulfonation | CYP2C9 CYP2C19 |
CYP3A4 |
| สัดส่วนที่ขับออก ทางอุจจาระ [%] |
70 |
|
90 | 83 | 93 | 71 | 90 | 58 |
| การเข้าสู่ระบบ ประสาทส่วนกลาง |
ไม่เข้า |
|
ไม่เข้า | เข้า | ไม่เข้า | ไม่เข้า | ไม่เข้า | เข้า |
| ขนาดยาสูงสุด ต่อวัน [mg] |
80 |
|
80 | 80 | 4 | 40 | 40 | 80 |
| โปรตีนขนส่งที่ใช้ ในการขับยาออก ทางน้ำดีและเปลี่ยน แปลงยาที่ตับ |
OATP1B1 |
|
OATP1B1 |
OATP1B1 |
OATP1A2 |
OATP1B1 |
OATP1A2 |
OATP1B1 |
การเปลี่ยนแปลงยาภายในร่างกาย

ยากลุ่มสแตตินทุกชนิด ยกเว้น ปราวาสแตติน จะถูกละลายในกระเพาะอาหารและภายในไซโตพลาสึมของเซลล์ และเมื่อยาถูกดูดซึมเข้าสู่กระแสเลือดจะถูกเปลี่ยนแปลงอย่างรวดเร็วภายในผนังลำไส้เล็กและตับโดยผ่านเอนไซม์ไซโตโครมพี 450 (cytochrome P450) หลากหลายไอโสเอนไซม์โลวาสแตตินและซิมวาสแตตินซึ่งถูกบริหารเข้าสู่ร่างกายในรูปแบบยาที่ยังไม่สามารถออกฤทธิ์ได้ (inactive drug หรือ prodrug) อาจเกิดปฏิกิริยาการเปลี่ยนแปลงยาได้ทางใดทางหนึ่งต่อไปนี้ คือ เกิดปฏิกิริยาไฮโดรไลสิสของวงแหวนแลคโตน (lactone ring) โดยเอนไซม์เอสเทอรเรส (esterase) หรือเปอรอกซิเดส (peroxidase) จนกลายเป็นยาที่มีหมุ่ไฮดรอกซี่ซึ่งสามารถออกฤทธิ์ได้ หลังจากนั้นยาในรูปแบบที่ออกฤทธิ์ได้นี้ ก็จะถูกเปลี่ยนแปลงโดยไอโสเอนไซม์ซีวายพี 3เอ4 (CYP 3A4) ให้กลายเป็นสารที่ไม่ออกฤทธิ์, และอีกหนึ่งกลไกการเปลี่ยนแปลงยาสแตติน คือ ตัวยาที่ถูกรับประทานเข้าไปจะถูกเปลี่ยนแปลงโดยไอโสเอนไซม์ซีวายพี 3เอ4 (CYP 3A4) ให้กลายเป็นสารที่ไม่ออกฤทธิ์เลย หรืออาจเกิดการเปลี่ยนแปลงผ่านซีวายพี 3เอ5 (CYP 3A5) ให้กลายเป็นสารที่มีฤทธิ์ในการรักษาลดน้อยลง นอกจากนี้แล้ว ยากลุ่มสแตตินนี้ยังสามารถถูกเปลี่ยนแปลงให้กลายเป็นวงแหวนแลคโตนที่มีกลไกการออกฤทธิ์คล้ายคลึงกับโคเอนไซม์เอ แต่กระบวนการการเกิดการเปลี่ยนแปลงดังกล่าวในมนุษย์นั้นจำเป็ต้องอาศัยเอนไซม์ยูดีพี-กลูคิวโรโนซิลทรานส์เฟอเรส (UDP-glucuronosyltransferase; UGT) ซึ่งไม่ใช่กระบวนการหลักในการเปลี่ยนแปลงสแตติน เพราะโดยส่วนใหญ่แล้ว วงแหวนแลคโตนของสแตตินนั้นมักจะถูกเปลี่ยนแปลงโดยเอนไซม์ซีวายพี (CYP450) ได้อย่างรวดเร็ว ส่วนพิทาวาสแตติน, ปราวาสแตติน และโรสุวาสแตตินนั้นจะถูกขับออกจากร่างกายผ่านทางน้ำดีในรูปแบบที่ไม่เปลี่ยนแปลง
รูปแบบการเปลี่ยนแปลงยากลุ่มสแตตินผ่านไซโตโครมพี 450 (cytochrome P450) ที่ตับนั้น ในปัจจุบันสามารถจำแนกรายละเอียดออกเป็นดังนี้:
- สแตตินที่ละลายในไขมันได้ดีที่อยู่ในรูปแบบของโปรดรักที่มีหมู่แทนที่เป็นวงแหวนแลคโตน เช่น ซิมวาสแตติน นั้น เบื้องต้นจะถูกเปลี่ยนแปลงได้โดยเอนไซม์ซีวายพี (CYP)
- สแตตินที่ละลายในน้ำได้ดี เช่น ปราวาสแตติน, โรสุวาสแตติน จะถูกเปลี่ยนแปลงที่ organic anion-transporting polypeptide (OATP) ที่ตับ, sodium-taurocholate cotransporting polypeptide (NTCP) และ OATP ที่ไต
- สแตตินชนิดอื่น เช่น ฟลูวาสแตติน จะถูกเปลี่ยนแปลงโดยเอนไซม์ซีวายพี (CYP) และถูกขนส่งโดยกระบวนการขนส่งแบบใช้พลังงาน (active transport) เข้าไปยังเซลล์ตับ
- สแตตินทุกชนิดมีความสามารถในการจับกับ multidrug resistance protein 2 MRP2, outer bile acid export pump (BSEP), P-glycoprotein (P-gp) และ breast cancer resistance protein (BCRP)
ตารางต่อไปนี้เป็นตารางแสดงรายละเอียดการเปลี่ยนแปลงของสแตตินภายในร่างกายมนุษย์ รวมไปถึงเอนไซม์ที่ใช้ในการเปลี่ยนแปลงยาแต่ละชนิดด้วย
| ค่าพารามิเตอร์ | อะโทวาสแตติน | เซอริวาสแตติน | ฟลูวาสแตติน | โลวาสแตติน | พิทาวาสแตติน | ปราวาสแตติน | โรสุวาสแตติน | ซิมวาสแตติน |
| การเกิดเมทาบอลิซึม | +++ |
|
+++ | +++ | ++ | + | + | +++ |
|---|---|---|---|---|---|---|---|---|
| จำนวน metabolite ที่ออกฤทธิ์ |
2 |
|
ไม่มี | 3 | ไม่เกี่ยวข้อง | 2 | ไม่เกี่ยวข้อง | 3 |
| ชนิดของ เอนไซม์ CYP |
CYP3A4 CYP2C8 |
CYP2C8 |
CYP2C9 | CYP3A4 CYP3A5 CYP2C8 |
CYP2C9 | CYP3A4 | CYP2C9 CYP2C19 |
CYP3A4 CYP3A5 CYP2C8 |
| ชนิดของ เอนไซม์ UGT |
UGT1A1 UGT1A3 UGT2B7 |
UGT1A3 |
UGT1A1 UGT1A3 UGT2B7 |
UGT1A3 UGT2B7 |
UGT1A1 UGT1A3 UGT2B7 |
|||
| การจับกับ โปรตีน |
SLCO1B1 |
|
SLCO1B1 | SLCO1B1 MC4 |
SLCO1B1 SLCO1B3 |
SLCO1B1 SLCO2B1 OAT3 MCT1 |
SLCO1B1 SLCO1B3 SLCO2B1 SLCO1A2 SLC10A1 |
SLCO1B1 |
| การแทนที่ โปรตีน |
ABCB1 ABCG2 |
ABCC2 ABCG2 |
ABCG2 | ABCB1 | ABCB1 ABCC2 ABCG2 |
ABCB1 ABCB11 ABCC2 ABCG2 |
ABCB1 ABCC2 ABCG2 |
ABCB1 |
การใช้ประโยชน์ทางการแพทย์
สแตตินเป็นยาที่ถูกนำมาใช้เพื่อรักษาภาวะไขมันในกระแสเลือดสูงในเด็กอายุ 6 ปี, วัยรุ่น และผู้ใหญ่ เพื่อเป็นการป้องกันปฐมภูมิหรือทุติยภูมิสำหรับการเกิดโรคหลอดเลือดหัวใจ ควบคู่ไปกับการปรับเปลี่ยนพฤติกรม จากข้อมูลที่ได้จากการศึกษาหลายการศึกษาพบว่าการใช้ยากลุ่มสแตตินจะสามารถลดระดับไลโปรโปรตีนชนิดความเข้มข้นต่ำ (LDL) ในกระแสเลือดลงได้ประมาณ 40 mg/dL นอกจากนี้แล้วการใช้สแตตินยังมีผลดีอีกหลายประการ ดังต่อไปนี้:
- ความเสี่ยงต่อการเสียชีวิตจากทุกสาเหตุ (total mortality) ลดลง 10%
- ความเสี่ยงต่อการเสียชีวิตจากโรคหลอดเลือดหัวใจ (cardiovascular disease) ลดลง 20%
- ความเสี่ยงต่อการเกิดโรคหลอดเลือดหัวใจที่รุนแรง (major cardiovascular events) ลดลง 23%
- ความเสี่ยงต่อการเกิดโรคหลอดเลือดสมอง (stroke) ลดลง 17%
ข้อบ่งใช้ที่จดทะเบียนรับรอง
- รักษาภาวะไขมันในเลือดสูงที่อาจมีสาเหตุจากพันธุกรรม (primary hypercholesterolemia) หรือภาวะไขมันในเลือดสูงหลายชนิด (mixed dyslipidaemia) โดยใช้เป็นการรักษาเสริมร่วมกับการปรับเปลี่ยนพฤติกรรมการรับประทานอาหารและการออกกำลังกาย ในกรณีที่ใช้วิธีการรักษาโดยไม่ใช้ยาแล้วไม่ได้ผล
- รักษาภาวะไขมันในเลือดสูงที่อาจมีสาเหตุจากพันธุกรรม (primary hypercholesterolemia) ในผู้ใหญ่ วัยรุ่น และเด็กอายุตั้งแต่ 6 ปีขึ้นไป รวมไปถึงการรักษาไขมันในเลือดสูงจากพันธุกรรมแบบยีนเดียว (heterozygous familial hypercholesterolaemia; type IIa) หรือภาวะไขมันในเลือดสูงหลายชนิด (mixed dyslipidaemia; type IIb) โดยใช้เป็นการรักษาเสริมร่วมกับการปรับเปลี่ยนพฤติกรรมการรับประทานอาหารและการออกกำลังกาย ในกรณีที่ใช้วิธีการรักษาโดยไม่ใช้ยาแล้วไม่ได้ผล
- รักษาภาวะไขมันในเลือดสูงจากพันธุกรรมแบบยีนเดียว (heterozygous familial hypercholesterolaemia) โดยเป็นการรักษาเสริมจากการควบคุมการรับประทานอาหารหรือการรักษาด้วยวิธีอื่นๆ (เช่น การฟอกเลือดเพื่อเอา LDL ออก) เพื่อลดระดับความเข้มข้นของไขมันในกระแสเลือด หรือเมื่อไม่มีการรักษาอื่น หรือเมื่อการรักษาอื่นไม่เพียงพอ
- รักษาภาวะไขมันในเลือดสูงจากพันธุกรรมแบบยีนเดียว (heterozygous familial hypercholesterolaemia)
- รักษาภาวะไขมันในเลือดสูงจากพันธุกรรมแบบยีนเดียว (heterozygous familial hypercholesterolaemia) ในเด็กและวัยรุ่น (วัยรุ่นชายที่มี Tanner scale ตั้งแต่ระดับ II ขึ้นไป, เพศหญิงต้องเป็นวัยที่มีประจำเดือนมาแล้วอย่างน้อย 1 ปี, หรือมีอายุ 10-17 ปี)
- ป้องกันการเกิดโรคหลอดเลือดหัวใจ (cardiovascular disease) ในผู้ที่มีความเสี่ยงที่จะเกิดโรคดังกล่าวสูง
- ลดระดับไขมันในเลือดในผู้ป่วยที่ได้รับการปลูกถ่ายอวัยวะที่ได้รับยากดภูมิคุ้มกัน
- ลดการเกิดความพิการและการเสียชีวิตจากโรคหลอดเลือดหัวใจในผู้ที่เป็นโรคหลอดเลือดแข็งและ/หรือโรคเบาหวาน ทั้งที่มีระดับไขมันในเลือดสูงหรือเป็นปกติ โดยใช้เป็นการรักษาเสริมร่วมกับการลดปัจจัยเสี่ยงอื่นที่อาจเป็นสาเหตุที่จะทำให้เกิดโรคหลอดเลือดหัวใจได้
- ลดการเกิดความพิการและการเสียชีวิตจากโรคหลอดเลือดหัวใจในผู้ที่เป็นโรคกล้ามเนื้อหัวใจขาดเลือดเฉียบพลัน (acute myocardial infarction) และผู้ป่วยโรคกล้ามเนื้อหัวใจขาดเลือดชนิดที่ไม่มั่นคง (unstable angina pectoris) ทั้งที่มีระดับไขมันในเลือดสูงหรือเป็นปกติ โดยใช้เป็นการรักษาเสริมร่วมกับการลดปัจจัยเสี่ยงอื่นที่อาจเป็นสาเหตุที่จะทำให้เกิดโรคหลอดเลือดหัวใจได้
- ใช้เป็นการป้องกันทุติยภูมิ (secondary prevention) สำหรับโรคหลอดเลือดหัวใจที่รุนแรงหลังการได้รับการรักษาหลอดเลือดหัวใจตีบตันผ่านสายสวน (Percutaneous Coronary Intervention; PCI)
- ชะลอการดำเนินของโรคหลอดเลือดหัวใจแข็ง (coronary atherosclerosis) ในผู้ป่วยโรคหลอดเลือดหัวใจ โดยใช้ร่วมกับการรักษาอื่นเพื่อลดความเข้มข้นของคอเลสเตอรอลโดยรวม (total cholesterol) และไลโปโปรตีนคอเลสเตอรอลชนิดความหนาแน่นต่ำ (LDL)
ข้อบ่งใช้ตามแนวทางการรักษาภาวะไขมันในเลือดสูงของสหภาพยุโรป ESC/EAS 2011
แนวทางการรักษาโรคไขมันในเลือดสูงของสมาคมหัวใจแห่งสหภาพยุโรป (European Society of Cardiology; ESC) และสมาคมโรคหลอดเลือดแข็งแห่งสหภาพยุโรป (European Society of Atherosclerosis; EAS) ปี ค.ศ. 2011 ได้ให้คำแนะนำในการเลือกใช้ยาเพื่อบำบัดรักษาภาวะความผิดปกติดังกล่าวไว้ ดังแสดงต่อไปนี้:
|
| ||
| ↓ | ||
| เลือกวิธีการรักษาเพื่อลดความเสี่ยงต่อการเกิดโรคหลอดเลือดหัวใจ | ||
| ↓ | ||
| กำหนดระดับ LDL เป้าหมาย ตามระดับความเสี่ยงของผู้ป่วยแต่ละราย | ||
| ↓ | ||
| ประเมินร้อยละของ LDL ที่ต้องการลด โดยเทียบกับ LDL พื้นฐานของผู้ป่วย | ||
| ↓ | ||
| เลือกชนิดยาสแตติน | ||
| ↓ | ||
| ประเมินประสิทธิภาพการรักษา/ติดตามปรับขนาดยาให้เหมาะสม | ||
| ↓ | ||
| ประเมินประสิทธิภาพการรักษา/ผลการรักษาซ้ำ | ||
| ระดับความเสี่ยง | ลักษณะทางประชากรศาสตร์ของผู้ป่วย | LDL เป้าหมาย (mg/dl) |
LDL เป้าหมาย (mmol/l) |
| สูงมาก |
|
<70 | <1,8 |
| สูง |
|
<100 | <2,5 |
| ปานกลาง |
|
<115 | <3,0 |
| น้อย |
|
ไม่สามารถระบุได้ | |

|
ความเสี่ยงของผู้ป่วยที่ยังไม่เคยได้รับการวินิจฉัยว่ามีความเสี่ยงต่อการเกิดโรคหลอดเลือดหัวใจนั้นจะประเมินจากปัจจัยต่างๆ 5 ปัจจัย (เพศ, อายุ, การสูบบุหรี่, ระดับคอเลสเตอรอลในเลือดรวม, และระดับความดันโลหิตขณะหัวใจบีบตัว) ซึ่งจะมีตารางการประเมินความเสี่ยงจากปัจจัยดังกล่าวโดยเฉพาะ โดยประเทศที่มีความเสี่ยงต่อการเกิดโรคหลอดเลือดหัวใจต่ำ ได้แก่ อันดอร์รา, ออสเตรีย, เบลเยียม, ไซปรัส, เดนมาร์ก, ฟินแลนด์, ฝรั่งเศส, กรีซ, สเปน, เนเธอร์แลนด์, ไอร์แลนด์, ไอซ์แลนด์, อิสราเอล, ลักเซมเบิร์ก, มอลตา, โมร็อคโค, เยอรมนี, นอร์เวย์, โปรตุเกส, ซานมารีโน, สโลวีเนีย, สวีเดน, สวิสเซอร์แลนด์ และสหราชอาณาจักร ส่วนประเทศอื่นนอกเหนือจากที่ได้กล่าวมาดังข้างต้นถือว่าเป็นประเทศที่มีความเสี่ยงสูงต่อการเกิดโรคหัวใจและหลอดเลือด อย่างไรก็ตามผลการประเมินของประชากรในประเทศอาร์เมเนีย, อาเซอร์ไบจาน, เบลารุส, บัลแกเรีย, จอร์เจีย, คาซัคสถาน, คีร์กีซสถาน, ลัตเวีย, ลิทัวเนีย, มาซิโดเนีย, มอลโดวา, รัสเซีย, ยูเครน, และอาเซอร์ไบจานนั้นอาจเป็นค่าที่ต่ำกว่าปกติได้ |
| คะแนนความเสี่ยง ต่อการเสียชีวิต (%) |
ระดับคอเลสเตอรอล (mg/dL) | |||||
|---|---|---|---|---|---|---|
| <70 | 70–99 | 100–154 | 155–190 | >190 | ||
| ระดับคอเลสเตอรอล (mmol/l) | ||||||
| <1.8 | 1.8–2.4 | 2.5–3.9 | 4.0–4.8 | >4.9 | ||
| <1 | ||||||
| 1–4 | ||||||
| 5–9 | ||||||
| ≥10 | ||||||
|
ไม่ต้องได้รับการรักษา | ||||||
ข้อบ่งใช้ตามแนวทางการรักษาภาวะไขมันในเลือดสูงของสหรัฐอเมริกา ACC/AHA 2013
ตามแนวทางการรักษาภาวะไขมันในกระแสเลือดสูงของวิทยาลัยแพทย์โรคหัวใจแห่งสหรัฐอเมริกา (American College of Cardiology; ACC) และสมาคมโรคหัวใจแห่งสหรัฐอเมริกา (American Heart Association; AHA) ค.ศ. 2013 ได้แนะนำให้ใช้สแตตินชนิดที่มีความแรงมาก (high potency statin) ได้แก่ อะโทวาสแตติน 80 มิลลิกรัม หรือโรสุวาสแตติน 20-40 มิลลิกรัม ในการรักษาผู้ป่วยที่มีความเสี่ยงสูงมากต่อการเกิดโรคหัวใจและหลอดเลือด ซึ่งการใช้ยาสแตตินกลุ่มดังกล่าวนั้นจะสามารถลดระดับความเข้มข้นของคอเลสเตอรอลในกระแสเลือดของผู้ป่วยลงได้มากกว่า 50% เมื่อเปรียบเทียบกับค่าก่อนการได้รับการรักษา ส่วนในกรณีที่ไม่สามารถใช้สแตตินชนิดที่มีความแรงมากได้ อาจพิจารณาใช้สแตตินที่มีความแรงปานกลาง (moderate potency statin) ทดแทนได้ ได้แก่ อะโทวาสแตติน 10-20 มิลลิกรัม, โรสุวาสแตติน 5-10 มิลลิกรัม, ซิมวาสแตติน 20-40 มิลลิกรัม, ปราวาสแตติน 40-80 มิลลิกรัม, โลวาสแตติน 40 มิลลิกรัม, ฟลูวาสแตติน เอ็กซ์แอล 80 มิลลิกรัม, ฟลูวาสแตติน 80 มิลลิกรัม, หรือพิทาวาสแตติน 2-4 มิลลิกรัม ซึ่งการใช้ยาสแตตินกลุ่มดังกล่าวนั้นจะสามารถลดระดับความเข้มข้นของคอเลสเตอรอลในกระแสเลือดของผู้ป่วยลงได้ประมาณ 30-49% เมื่อเปรียบเทียบกับค่าก่อนการได้รับการรักษา
| ลักษณะทางประชากรของผู้ป่วย | ชนิดของสแตติน ที่แนะนำ |
เป้าหมาย LDL ที่ลดลง (%) |
| ผู้ป่วยที่เป็นโรคหลอดเลือดหัวใจหรือโรคหลอดเลือดแข็ง | ชนิดความแรงมาก | <50% |
| ผู้ป่วยที่มีระดับ LDL >190 mg/dl (4,9 mmol/l) | ชนิดความแรงมาก | <50% |
| ผู้ป่วยโรคเบาหวาน อายุ 40–75 ปี ที่มีระดับ LDL-C 70–189 mg/dl (1,8–4,9 mmol/l) แต่ยังไม่เป็นโรคหลอดเลือดหัวใจ | ชนิดความแรงปานกลาง | 30-49% |
| ผู้ป่วยที่ไม่เป็นโรคหลอดเลือดหัวใจและไม่เป็นเบาหวาน, อายุ 40–79 ปี, ระดับ LDL-C 70–189 mg/dl (1,8–4,9 mmol/l) ที่มีความเสี่ยงต่อการเกิดโรคหลอดเลือดหัวใจใน 10 ปีข้างหน้า (10 years risk scores for cardiovascular diseases) ≥7,5%. | ชนิดความแรงปานกลาง หรือ ชนิดความแรงมาก |
30-49% หรือ <50% |
ข้อบ่งใช้อื่นที่เป็นผลจากการศึกษาทางคลินิก
โรคกระดูกพรุน
โรคกระดูกพรุน (อังกฤษ: Osteoporosis) ตามคำนิยามขององค์การอนามัยโลก (World Health Organization) หมายถึง ภาวะที่มีลดลงของมวลกระดูกและมีการเปลี่ยนแปลงของกระดูกชิ้นเล็กๆ บางๆ (trabeculae) เชื่อมโยงกันเป็นร่างแหภายในกระดูก ซึ่งการเปลี่ยนแปลงนี้จะนำไปสู่ความผิดปกติของโครงสร้างจุลภาคภายในกระดูก (defective bone microstructure) ทำให้กระดูกมีความแข็งแรงลดน้อยลงและเสี่ยงต่อการเกิดการแตกหักได้ง่าย โดยความชุกของการเกิดโรคกระดูกพรุนในประชากรที่มีอายุมากกว่า 50 ปีขึ้นไปคือ 14% โดยมักพบความชุกในเพศหญิงมากกว่าเพศชาย คือ 24% และ 6% ตามลำดับ โดยพยาธิกำเนิดของโรคกระดูกพรุนนั้นเกิดจากความผิดปกติของสมดุลระหว่างกระบวนการสร้างและสลายกระดูก ซึ่งมีความสัมพันธ์กับการกับมีอายุที่เพิ่มมากขึ้น ทำให้เกิดกระบวนการสลายกระดูกในอัตราที่มากกว่าการสร้าง ซึ่งปัจจัยเสริมส่วนหนึ่งมาจากการมีระดับฮอร์โมนเพศที่ลดลง (เช่น เอสโทรเจน, เทสโทสเทอโรน) หรือความผิดปกติของการสร้างตัวกระตุ้นการเจริญเติบโตที่มีโครงสร้างคล้ายอินซูลิน (insulin-like growth factor-I; IGF-1) หรือความผิดปกติของสมดุลแคลเซียม-ฟอสเฟตของร่างกาย ซึ่งอาจเกิดได้จากทั้งการรับประทานอาหารที่มีแร่ธาตุเหล่านี้ไม่เพียงพอ, ร่างกายดูดวึมแร่ธาตุดังกล่าวได้น้อยลง, โปรตีนที่ใช้ขนส่งแร่ธาตุดังกล่าวมีปริมาณลดลง, ความเป็นกรดของกระเพาะอาหารลดลง, การสร้างวิตามินดีในรูปแบบที่ออกฤทธิ์ได้ที่ตับและไตผิดปกติ, การได้รับแสงอาทิตย์ไม่เพียงพอ, หรือแม้กระทั่งการมีระดับพาราไทรอยด์ฮอร์โมนที่มากเกินไป
ในปัจจุบัน มียาที่ใช้ในการรักษาโรคกระดูกพรุนหลายชนิด โดยกลไกการออกฤทธิ์ของยาเหล่านี้อาจจะออกฤทธิ์รบกวนกระบวนการสลายกระดูกและการดูดซึมแคลเซียมกลับของร่างกาย เช่น กลุ่มยากลุ่มยาบิสฟอสโฟเนต (Bisphosphonates), ดีโนซูแมบ (denosumab), การรักษาด้วยฮอร์โมนทดแทน (hormone replacement therapy), ยากระตุ้นตัวรับเอสโทรเจนอย่างจำเพาะ (selective estrogen receptor modulators; SERMs); หรือออกฤทธิ์เร่งการสร้างกระดูก เช่น เทอริพาราไทด์ (teriparatide); หรือออกฤทธิ์แบบหลายกลไกผสมกัน เช่น สทรอนเทียม ราเนเลต (strontium ranelate) ส่วนกลไกของสแตตินต่อกระบวนการสร้างและสลายกระดูกนั้นยังไม่สามารถอธิบายได้แน่ชัด และข้อมูลที่ได้จากการศึกษาล่าสุดคาดว่าน่าจะเกิดจากทั้งการส่งเสริมการสร้างมวลกระดูกและยับยั้งการสลายมวลกระดูกร่วมกัน โดยกลไกต่อไปนี้:
- สแตตินจะกระตุ้นการแสดงออกของ mRNA ที่ทำหน้าที่สร้างโปรตีน Bone morphogenetic protein 2 (ฺBMP-2) ซึ่งมีบทบาทสำคัญในการสร้างกระดูกและการกระตุ้นให้เกิดการแบ่งตัวของเซลล์สร้างกระดูก (osteoblasts)
- ลดจำนวนของเซลล์สลายกระดูก (osteoclasts)
- ยับยั้งการสร้างตัวกระตุ้นตัวรับเซลล์สลายกระดูก (receptor activator) บน nuclear factor-κ B (NF-κB)
- กระตุ้นโปรตีนไคเนส-บี (protein kinase B หรือ Akt) เป็นผลให้มีการสร้าง endothelial nitric oxide synthase (eNOS) เพิ่มมากขึ้น
ผลการลดความเสี่ยงต่อการเกิดโรคกระดูกพรุนของสแตตินนั้น โดยส่วนใหญ่แล้วพบในสแตตินที่ละลายในไขมัน (เช่น ซิมวาสแตติน, โลวาสแตติน, อะโทวาสแตติน) และสแตตินสังเคราะห์เป็นหลัก (เช่น ฟลูวาสแตติน, โรสุวาสแตติน, อะโทวาสแตติน) อย่างไรก็ตาม ผลต่อการลดความเสี่ยงต่อการเกิดโรคกระดูกพรุนนี้ยังสรุปได้ไม่แน่ชัดนัด เนื่องจากการศึกษาในห้องทดลองกับการศึกษาในมนุษย์นั้นให้ผลการศึกษาที่ขัดแย้งกัน
โรคติดเชื้อ
โรคติดเชื้อ (อังกฤษ: Infectious diseases) เป็นกลุ่มโรคที่มีสาเหตุมาจากเชื้อจุลชีพหรือสารพิษที่ถูกหลั่งออกมาจากเชื้อจุลชีพที่เจริญเติบโตในร่างกายมนุษย์ และระบบภูมิคุ้มกันของร่างกายมนุษย์ไม่สามารถกำจัดเชื้อหรือสารพิษเหล่านั้นออกไปได้ทันท่วงที จนทำให้เกิดอาการของโรคติดเชื้อในที่สุด ซึ่งแหล่งที่มาของโรคนี้อาจได้รับเชื้อมาจากสัตว์, พืช, สิงปฏิกูล, สิ่งแวดล้อม, หรือแม้แต่จากมนุษย์ด้วยกันเอง
โดยพยาธิกำเนิดของโรคติดเชื้อนั้นเกิดจากกระบวนการกระตุ้นระบบภูมิคุ้มกันของร่างกายให้มีการหลั่งสารสื่อการอักเสบ (cytokines) ชนิดต่างๆ ออกมา ซึ่งกระบวนการดังกล่าวนั้น สามารถถูกควบคุมได้โดยยากลุ่มสแตติน โดยสแตตินจะไปมีผลลดสารกลุ่มไอโซพรีนอยด์ (isoprenoids) ซึ่งเป็นหนึ่งในสารตั้งต้นที่ใช้ในการสังเคราะห์คอเลสเตอรอล และมีความจำเป็นในกระบวนการปฏิกิริยาพรีนิลเลชั่น (prenylation) ของโปรตีนที่ใช้ในการสื่อสารระหว่างเซลล์เพื่อตอบสนองต่อการอักเสบของร่างกาย นอกจากนี้แล้ว สแตตินยังส่งผลต่อการตอบสนองต่อการอักเสบโดยการลดการแสดงออกของยีนที่ทำหน้าที่สร้างโปรตีนเกี่ยวเนื่องกับการอักเสบที่มีชื่อว่า MHC (major histocompatibility complex) class II อย่างไรก็ตาม ผลที่แน่ชัดของสแตตินต่อการเกิดโรคติดเชื้อนั้นยังไม่เป็นที่ทราบเด่นชัดนัก ถึงแม้จะมีการศึกษาบางการศึกษาที่พบว่าการใช้สแตตินจะลดความเสี่ยงต่อการติดเชื้อหรือลดอัตราการเสียชีวิตจากโรคติดเชื้อได้บ้างก็ตาม และโดยทั่วไปแล้ว การรักษาโรคติดเชื้อมักจะเป็นการใช้ยาปฏิชีวนะร่วมกับการรักษาตามอาการมากกว่า จึงทำให้ในปัจจุบันยังคงขาดข้อมูลที่สามารถยืนยันได้แน่ชัดเกี่ยวกับผลสแตตินต่อโรคติดเชื้อต่างๆ
โรคปอดอักเสบ
โรคปอดอักเสบ (อังกฤษ: Pneumonia) เป็นโรคที่เกิดจากการอักเสบของปอดอันเนื่องมาจากการมีเชื้อจุลชีพในถุงลมของปอด มีการคั่งของน้ำหรือหนองในปอด ทำให้เกิดอาการไอ อาจไอมีเสมหะหรือมีมูกหนอง, ไข้,หนาวสั่น, และหายใจลำบาก โดยในการศึกษาทางคลินิกที่ผ่านมาพบว่า สแตตินมีผลลดความรุนแรงของโรคและลดอัตราการเสียชีวติในผู้ป่วยกลุ่มดังกล่าวลงได้ โดยเฉพาะในผู้ป่วยโรคปอดอุดกั้นเรื้อรัง (chronic obstructive pulmonary disease; COPD) แต่ไม่มีผลลดอุบัติการณ์การเกิดโรคปอดอักเสบทั้งในโรงพยาบาลและในชุมชน
ไข้หวัดใหญ่
ไข้หวัดใหญ่ (อังกฤษ: influenza หรือ flu) เป็นโรคติดเชื้อที่เกิดจากไวรัสไข้หวัดใหญ่ ซึ่งผู้ป่วยอาจมีอาการของโรคเพียงเล็กน้อยไปถึงขั้นรุนแรง โดยอาการที่พบบ่อยที่สุด ได้แก่ ไข้สูง, คัดจมูก, เจ็บคอ, ปวดกล้ามเนื้อ, ปวดศีรษะ, ไอและรู้สึกเหนื่อย ซึ่งจะเริ่มมีอาการเหล่านี้ประมาณสองวันหลังได้รับเชื้อและส่วนใหญ่แล้วมักมีอาการนานไม่เกินสัปดาห์ อย่างไรก็ตาม อาการไออาจกินเวลานานกว่าสองสัปดาห์ได้ ในผู้ป่วยเด็กอาจมีคลื่นไส้อาเจียน แต่ไม่ใช่อาการปกติในผู้ใหญ่ อาการแทรกซ้อนของไข้หวัดใหญ่อาจมีปอดบวมจากไวรัส ปอดบวมจากแบคทีเรียตาม โพรงอากาศ (sinus) ติดเชื้อ และปัญหาสุขภาพที่มีอยู่เดิมแย่ลง เช่น โรคหอบหืดหรือภาวะหัวใจล้มเหลว
การศึกษาทางคลินิกที่ผ่านมาพบว่าการใช้สแตตินจะสามารถลดอัตราการเสียชีวิตของผู้ป่วยไข้หวัดใหญ่ที่ต้องเข้ารับการรักษาในโรงพยาบาลได้ โดยสแตตินจะไปมีผลลดการเกิดภาวะแทรกซ้อนจากไข้หวัดใหญ่ เช่น ปอดอักเสบจากเชื้อแบคทีเรีย, หลอดเลือดสมองอุดกั้น, และภาวะหัวใจวายเฉียบพลัน เป็นต้น
บรรณานุกรม
-
Banach M, Filipiak KJ, and Opolski G (2013). Aktualny stan wiedzy na temat statyn. Poznań. ISBN 978-83-63622-21-3.
{{cite book}}: CS1 maint: multiple names: authors list (ลิงก์) -
Andrzej Folga, Marek Chmielewski, Artur Mamcarz (2010). Statyny. Warszawa, Poland: Medical Education. ISBN 978-83-927978-3-8.
{{cite book}}: CS1 maint: multiple names: authors list (ลิงก์) -
Renu Virmani, Jagat Narula, Martin B. Leon, James T. Willerson (2008). The Vulnerable Atherosclerotic Plaque: Strategies for Diagnosis and Management. Wiley-Blackwell. ISBN 978-0-470-98733-9.
{{cite book}}: CS1 maint: multiple names: authors list (ลิงก์) -
Dieter Steinhilber, Manfred Schubert-Zsilavecz, Hermann J. Roth (2012). Chemia Medyczna. Poland: MedPharm Polska. ISBN 978-83-62283-94-1.
{{cite book}}: CS1 maint: multiple names: authors list (ลิงก์) -
Artur Mamcarz, Andrzej Folga, Daniel Śliża, Marcin Wełnicki (2014). Leczenie zaburzeń lipidowych. Poland: Medical Tribune Polska. ISBN 978-83-62597-36-9.
{{cite book}}: CS1 maint: multiple names: authors list (ลิงก์) - Marcin Wełnicki, Artur Mamcarz (2013). Mała encyklopedia statyn. Medical Education. ISBN 978-83-62510-70-2.
แหล่งข้อมูลอื่น
- American Heart Association. "2013 Prevention Guideline Tools: CV Risk calculator". คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2016-01-26. สืบค้นเมื่อ February 7, 2016.
- European Society of Cardiology. "SCORE Risk Charts: The European cardiovascular disease risk assessment model". คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2016-08-10. สืบค้นเมื่อ February 7, 2016.
- Bayer. "Kalkulator ryzyka sercowo-naczyniowego: Opracowany na podstawie skali SCORE dla krajów dużego ryzyka, w tym dla Polski". สืบค้นเมื่อ February 7, 2016.
-
Brian L. Strom, , Rita Schinnar, Jason Karlawish, Sean Hennessy, P Valerie Teal, and Warren B. Bilker (2015). "Statin Therapy and Risk of Acute Memory Impairment". JAMA Intern Med. 178 (8): 1399-405. doi:10.1001/jamainternmed.2015.2092. สืบค้นเมื่อ February 7, 2016.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์)
|
ทางเดินอาหาร/ เมแทบอลิซึม (A) |
กรดกระเพาะ (ยาลดกรด, สารต้านตัวรับ H2 , ยายับยั้งการหลั่งกรด) • ยาแก้อาเจียน • ยาระบาย • ยาแก้ท้องร่วง • ยาลดความอ้วน • ยาต้านเบาหวาน • วิตามิน • เกลือแร่
|
|---|---|
|
เลือดและอวัยวะ สร้างเลือด (B) |
|
|
ระบบหัวใจ และหลอดเลือด (C) |
ยารักษาโรคหัวใจ/ยาแก้อาการปวดเค้นหัวใจ (คาร์ดิแอคไกลโคไซด์ , ยาต้านภาวะหัวใจเสียจังหวะ , ยากระตุ้นหัวใจ) • ยาลดความดัน • ยาขับปัสสาวะ • สารขยายหลอดเลือด • เบต้า บล็อกเกอร์ • แคลเซียมแชนแนลบล็อกเกอร์ • ระบบเรนิน-แองจิโอเทนซิน (เอซีอีอินฮิบิเตอร์ , แองกิโอเทนซินรีเซพเตอร์บล๊อคเกอร์ , เรนินอินฮิบิเตอร์) • ยาลดไขมันในเส้นเลือด (สแตติน , ไฟเบรต , ไบล์แอซิดซีเควสแตรนต์) |
| ผิวหนัง (D) | |
| ระบบสืบพันธุ์ (G) | |
| ระบบต่อมไร้ท่อ (H) | |
|
การติดเชื้อและ การติดเชื้อปรสิต (J, P, QI) |
|
| มะเร็ง (L01-L02) | |
| โรคทางระบบ ภูมิคุ้มกัน (L03-L04) |
|
| กล้ามเนื้อ กระดูก และข้อต่อ (M) | |
| สมองและระบบประสาท (N) | |
| ระบบทางเดินหายใจ (R) | |
| อวัยวะรับความรู้สึก (S) | |
| อื่น ๆ (V) | |