แบคทีเรียดื้อยา

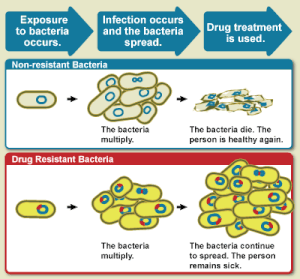
จุลชีพดื้อยา (อังกฤษ: Antimicrobial resistance; AMR) เป็นคำที่ใช้สื่อถึงจุลชีพที่มีความสามารถในการปรับตัวให้ทนต่อฤทธิ์ของยาต้านจุลชีพที่มีประสิทธิภาพในการรักษาโรคที่เกิดจากการติดเชื้อจุลชีพนั้น ๆ ในอดีต โดยคำนี้สื่อความรวมถึง "แบคทีเรียดื้อยา" หรือ "แบคทีเรียดื้อต่อยาปฏิชีวนะ" (antibiotic resistance) ด้วย ซึ่งเป็นจุลชีพที่พบการดื้อยามากที่สุด โดยการรักษาโรคที่เกิดจากการติดเชื้อจุลชีพที่ดื้อต่อยานั้นทำได้ค่อนข้างยาก จึงจำเป็นต้องมีการใช้ยาต้านจุลชีพในขนาดที่สูงกว่าปกติในการรักษา หรือต้องปรับเปลี่ยนแบบแผนการรักษาโดยใช้ยาทางเลือกรอง ซึ่งทำให้มีค่าใช้จ่ายในการรักษาที่สูงกว่าปกติ และมีความเสี่ยงที่อาจเกิดอาการไม่พึงประสงค์หรือการเกิดพิษได้มากกว่าการรักษาด้วยสูตรการรักษามาตรฐาน นอกจากนี้แล้ว การรักษาโรคที่เกิดจากการติดเชื้อจุลชีพดื้อยาดังกล่าวจะยิ่งทวีความยากลำบากในการรักษามากขึ้นหากเชื้อสาเหตุนั้นเกิดการดื้อยาต้านจุลชีพหลายชนิด (multiple drug resistance; MDR หรือ ซุปเปอร์บั๊ก) ทั้งนี้ กลไกการดื้อยาของจุลชีพนั้นสามารถเกิดขึ้นได้ผ่าน 3 กลไกหลัก คือ การดื้อยาโดยธรรมชาติของจุลชีพสายพันธุ์นั้น ๆ, การกลายพันธุ์ หรือ การได้รับยีนดื้อยาจากสายพันธุ์หรือสเตรนอื่น โดยจุลชีพสายพันธุ์ต่าง ๆ นั้นสามารถเกิดการกลายพันธุ์ได้ทั้งหมด ได้แก่ เชื้อราจะเกิดการดื้อต่อยาต้านเชื้อรา ไวรัสจะเกิดการดื้อต่อยาต้านไวรัส โพรโทซัวสามารถเกิดการต่อยาต้านโพรโทซัว และแบคทีเรียจะเกิดการดื้อต่อยาปฏิชีวนะ และการดื้อยานี้อาจเกิดขึ้นได้เองโดยธรรมชาติของจุลชีพซึ่งเป็นผลมาจากการกลายพันธุ์แบบสุ่ม
การป้องกันการดื้อยาของแบคทีเรียนั้นสามารถกระทำได้หลายช่องทาง ได้แก่ ใช้ยาปฏิชีวนะเมื่อมีข้อบ่งใช้ที่เหมาะสม หยุดการใช้ยาปฏิชีวนะหรือยาต้านจุลชีพอื่นในทางที่ผิด หากเป็นไปได้ให้พิจารณาใช้ยาปฏิชีวนะชนิดออกฤทธิ์แคบ (Narrow-spectrum antibiotics) แทนยาปฏิชีวนะชนิดออกฤทธิ์กว้าง (Board-spectrum antibiotics) เนื่องจากการใช้ยาปฏิชีวนะชนิดออกฤทธิ์แคบจะมีความจำเพาะต่อเชื้อสาเหตุและมีประสิทธิภาพมากกว่า ซึ่งจะช่วยลดความเสี่ยงของการเกิดการดื้อยาของจุลชีพได้ ในกรณีที่ต้องรับประทานยาเองที่บ้าน ผู้ใช้ยาควรมีความตระหนักรู้ถึงวิธีการใช้ยาที่เหมาะสม และความเสี่ยงที่อาจเกิดขึ้นได้จากการใช้ยาดังกล่าวนอกเหนือจากคำแนะนำของบุคลการทางการแพทย์ นอกจากนี้ บุคลากรทางการแพทย์ซึ่งมีโอกาสสัมผัสกับเชื้อจุลชีพต่าง ๆ ในการทำงานก็ถือเป็นภาคส่วนที่สำคัญที่จะช่วยลดการแพร่กระจายของแบคทีเรียดื้อยาได้ โดยการรักษาสุขอนามัยและการมีระบบการสุขาภิบาลที่ดีในสถานพยาบาล ซึ่งรวมไปถึงการล้างมือและการทำให้ปราศจากเชื้อ (disinfecting) ในระหว่างการสัมผัสผู้ป่วยแต่ละราย รวมไปถึงการให้ความรู้เพื่อกระตุ้นความตระหนักรู้ในประเด็นดังกล่าวแก่ผู้ป่วย ญาติผู้ป่วย หรือบุคคลอื่นในสถานพยาบาล
การเพิ่มขึ้นของแบคทีเรียดื้อยาในปัจจุบันนั้นมีสาเหตุหลักมาจกาการใช้ยาปฏิชีวนะในมนุษย์และสัตว์อื่น รวมไปถึงการแพร่กระจายของแบคทีเรียดื้อยาระหว่างมนุษย์กับสัตว์เหล่านั้น นอกจากนี้ การดื้อยาของแบคทีเรียนี้ยังทำให้เกิดการคัดเลือกจากแรงกดดัน (selection pressure) ในกลุ่มประชากรของแบคทีเรีย ส่งผลให้แบคทีเรียที่ไวต่อยาต้านจุลชีพตาย และแบคทีเรียที่ดื้อยาต้านจุลชีพซึ่งเดิมมีอยู่ในสัดส่วนที่น้อยนั้น มีจำนวนที่เพิ่มมากขึ้น การที่แบคทีเรียที่ดื้อยากลับกลายมาเป็นประชากรกลุ่มใหญ่ในสายพันธุ์นั้น ๆ ทำให้การรักษาโรคที่เกิดจากการติดเชื้อดังกล่าวต้องได้รับการปรับเปลี่ยนไปใช้การรักษาด้วยยาทางเลือกรอง รวมถึงทำให้เกิดการขาดแคลนยาปฏิชีวนะที่ใช้ในการรักษาจนทำให้ต้องการเร่งรัดการคิดค้นพัฒนายาปฏิชีวนะชนิดใหม่ที่รวบรัดขั้นตอนตามมาตรฐานการพัฒนายาใหม่ที่เคยมีมา อย่างไรก็ตาม ถึงแม้จะมีการเร่งรัดพัฒนายาปฏิชีวนะชนิดใหม่ขึ้นมาเพื่อจัดการกับภาวะฉุกเฉินที่เกี่ยวเนื่องกับแบคทีเรียดื้อยาดังข้างต้น แต่ยาปฏิชีวนะชนิดใหม่ที่ถูกผลิตออกสู่ตลาดยานั้นก็ยังคงมีจำนวนไม่มากพอที่จะบรรเทาปัญหาดังกล่าวลงได้
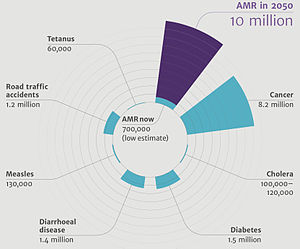
การเพิ่มขึ้นของการดื้อยาของแบคทีเรียนี้ ทำให้มีผู้เสียชีวิตจากการเจ็บป่วยด้วยโรคติดเชื้อดื้อยาอย่างรุนแรงประมาณปีละ 700,000 – 1,000,000 คนต่อปี เฉพาะในสหรัฐอเมริกา ในแต่ละปีจะมีผู้ที่เจ็บป่วยด้วยโรคติดเชื้อแบคทีเรียดื้อยาอย่างน้อย 2,000,000 คน และในจำนวนนี้มีผู้ที่ประสบความล้มเหลวในการรักษาและนำไปสู่การเสียชีวิตมากถึง 23,000 คนต่อปี ด้วยความรุนแรงแรงของปัญหาการดื้อยาของแบคทีเรียนี้ ทำให้มีการเรียกร้องให้ประชาคมโลกกำหนดมาตรการการดำเนินการร่วมกันเพื่อจัดการกับภัยคุกคามดังกล่าว จนได้เป็นข้อเสนอสำหรับสนธิสัญญาระหว่างประเทศเรื่องการดื้อต่อยาของจุลชีพ แต่การดำเนินงานดังกล่าวนั้นไม่อาจกระทำได้ในทุกประเทศทั่วโลก เนื่องจากบางประเทศที่มีฐานะยากจนและมีระบบการสาธารณสุขที่อ่อนแอนั้นไม่อาจดำเนินการตามเจตนารมณ์ดังกล่าวได้เต็มที่ ทำให้กลุ่มประเทศดังกล่าวมีอุบัติการณ์การเกิดการดื้อยาของจุลชีพที่ค่อนข้างสูง
คำจำกัดความ
องค์การอนามัยโลกได้ให้คำนิยามของ จุลชีพดื้อยา ว่าเป็น จุลชีพที่ทนต่อยาต้านจุลชีพที่เคยมีประสิทธิภาพดีในการรักษาโรคที่เกิดจากการติดเชื้อจุลชีพดังกล่าว ทั้งนี้การดื้อต่อยาปฏิชีวนะนี้เกิดขึ้นในจุลชีพเท่านั้น คนหรืออวัยวะที่เกิดการติดเชื้อจุลชีพนั้นไม่อาจก่อให้เกิดการดื้อยาปฏิชีวนะได้ ในปี ค.ศ. 2014 ด้วยความรุนแรงของการดื้อยาของจุลชีพทำให้องค์การอนามัยโลก (World Health Organization) ประกาศให้ปัญหาการดื้อยาของเชื้อแบคทีเรียเป็น "ปัญหาสำคัญเร่งด่วนที่สุดที่เกิดขึ้นในทุกภูมิภาคทั่วโลกและทุกคนล้วนจะต้องได้รับผลกระทบจากปัญหานี้ ไม่ว่าวัยใด หรือประเทศใดก็ตาม – การดื้อยานี้ทำให้แบคทีเรียเปลี่ยนแปลงไปจากเดิม ดังนั้น ยาปฏิชีวนะที่เคยใช้ได้ผลจะไม่สามารถใช้งานได้กับคนที่ต้องการการรักษาโรคที่เกิดติดเชื้อนี้ - นี่จึงถือเป็นภัยคุกคามหลักต่อการสาธารณสุขในปัจจุบัน"
สาเหตุ
ถึงแม้ว่าการดื้อต่อยาปฏิชีวนะของแบคทีเรียนั้นมีมาก่อนที่จะมีการใช้ยาดังกล่าวในมนุษย์ แต่การใช้ยาปฏิชีวนะโดยมนุษย์กันอย่างแพร่หลายในปัจจุบันนี้ทำให้การดื้อยาปฏิชีวนะของแบคทีเรียเพิ่มมากขึ้นกว่าปกติผ่านกระบวนการการกดดันทางวิวัฒนาการ (evolutionary pressure) ทั้งนี้ สาเหตุหลักที่ทำให้การใช้ยาปฏิชีวนะในมนุษย์ได้รับความนิยมเป็นอย่างมาก โดยเป็นผลมาจากความสามารถในการผลิตยาปฏิชีวนะในระดับอุตสาหกรรมเพิ่มขึ้นทั่วโลกตลอดทุกช่วงเวลาตั้งแต่ปี 1950 ทำให้ปริมาณยาปฏิชีวนะที่ผลิตขึ้นมีจำนวนมากพอที่จะจำหน่ายแก่ประชาชนได้อย่างกว้างขวาง ประกอบกับการที่รัฐไม่สามารถควบคุมการขายได้ โดยเฉพาะในกลุ่มประเทศรายได้น้อยและรายได้ปานกลางหลายประเทศ ซึ่งสามารถซื้อยาดังกล่าวได้โดยไม่ต้องใช้ใบสั่งยาจากแพทย์ และการซื้อยาใช้เองในกรณีดังกล่าว ส่วนใหญ่มักเป็นการใช้ยาปฏิชีวนะที่ไม่ตรงข้อบ่งใช้ ซึ่งจะส่งผลให้ความเสี่ยงที่อาจเกิดการดื้อยาปฏิชีวนะของแบคทีเรียสูงขึ้นได้ในทุก ๆ สายพันธุ์ที่มีอยู่ในปัจจุบัน
เหตุผลอื่น ๆ ที่ทำให้เกิดการดื้อยาของจุลชีพในปัจจุบัน ได้แก่:
- การใช้ยาปฏิชีวนะในการปศุสัตว์ โดยมีการรับรองให้มีการใช้ยาปฏิชีวนะในขนาดต่ำแก่ปศุสัตว์เพื่อเสริมการเจริญเติบโตของสัตว์ดังกล่าวในประเทศอุตสาหกรรมหลายประเทศ ซึ่งเป็นที่ทราบกันดีว่าการใช้ยาปฏิชีวนะในกรณีนี้สามารถนำไปสู่การเพิ่มขึ้นของการดื้อยาปฏิชีวนะของแบคทีเรียได้
- การปล่อยของเสียที่มีส่วนผสมของยาปฏิชีวนะอยู่ในปริมาณสูงสู่สิ่งแวดล้อมของโรงงานผลิตยา เนื่องจากไม่มีระบบการบำบัดน้ำเสีย (wastewater treatment) ที่ดีมากพอ ทำให้ความเสี่ยงที่จะเกิดการดื้อยาของแบคทีเรียในสิ่งแวดล้อมเพิ่มสูงมากขึ้น และแพร่กระจายได้มากขึ้น
- ถึงแม้จะยังไม่ทราบแน่ชัดว่าสารต้านแบคทีเรียในสบู่และผลิตภัณฑ์สุขภาพอื่นนั้นมีส่วนช่วยในการดื้อยาของแบคทีเรียหรือไม่ แต่อย่างไรก็ตาม องค์การอาหารและยาของสหรัฐอเมริกาได้ห้ามให้มีการใช้สารต้านแบคทีเรียจำนวน 19 ชนิดในผลิตภัณฑ์สบู่ต้านแบคทีเรียเมื่อวันที่ 2 กันยายน ค.ศ. 2016 ด้วยให้เหตุผลประกอบว่า "ไม่มีข้อมูลที่แสดงให้เห็นได้เด่นชัดว่าสบู่ที่มีส่วนผสมของสารต้านแบคทีเรียนั้นมีประสิทธิภาพดีกว่าการล้างทำความสะอาดด้วยน้ำเปล่าและสบู่ทั่วไปในการป้องกันภาวะความเจ็บป่วยจากแบคทีเรีย"
การดื้อยาจากการใช้ยาปฏิชีวนะในมนุษย์
การเพิ่มขึ้นของการดื้อยาปฏิชีวนะของแบคทีเรียนั้นมีความสัมพันธ์กับปริมาณการสั่งใช้ยาหรือการใช้ยาดังกล่าว รวมไปถึงการรับประทานยาปฏิชีวนะไม่ครบตามที่ได้ควรได้รับ โดยการสั่งยาใช้ปฏิชีวนะที่ไม่เหมาะสมนี้มีสาเหตุมาจากหลายประการ ทั้งจากการที่ผู้ป่วยยืนยันที่จะให้แพทย์สั่งใช้ยาปฏิชีวนะแก่ตน ถึงแม้จะไม่มีข้อบ่งชี้ที่จำเป็นต้องใช้ยาดังกล่าว และแพทย์บางรายก็อาจสั่งจ่ายยาปฏิชีวนะให้แก่ผู้ป่วยของตนตามที่ร้องขอ เนื่องจากไม่มีเวลามากพอที่จะอธิบายให้ผู้ป่วยตระหนักรู้ได้ถึงเหตุผลที่ไม่ควรใช้ยาปฏิชีวนะในการรักษาการเจ็บป่วยครั้งนั้น ๆ และในบางกรณี แพทย์ผู้สั่งใช้ยาเองก็ไม่ทราบแน่ชัดว่าเมื่อใดที่จำเป็นต้องใช้ยาปฏิชีวนะหรือมีความระมัดระวังมากเกินไปในการสั่งใช้ยาเนื่องมาจากเหตุผลทางการแพทย์ รวมไปถึงเหตุผลทางกฎหมาย นอกจากนี้แล้ว การที่มีระดับความเข้มข้นของยาปฏิชีวนะในร่างกายต่ำมากเกินไปก็อาจก่อให้เกิดการดื้อยาของแบคทีเรียได้ผ่านกระบวนการการเหนี่ยวนำให้เกิดการกลายพันธุ์ของแบคทีเรียนั้น ๆ ส่งผลให้แบคทีเรียดังกล่าวสามารถเจริญเติบโตอยู่ได้ตามปกติถึงแม้จะมีการรักษาด้วยยาปฏิชีวนะชนิดเดิมที่ให้ความเข้มข้นของยาในกระแสเลือดมากขึ้นกว่าเดิมก็ตาม ยกตัวอย่างเช่น การดื้อยาของแบคทีเรีย Pseudomonas aeruginosa และ Bacteroides fragilis ที่ถูกเหนี่ยวนำให้เกิดการกลายพันธุ์จากการได้รับยาปฏิชีวนะในขนาดที่ให้ความเข้มข้นของยาดังกล่าวในร่างกายต่ำกว่าความเข้มข้นต่ำสุดที่สามารถยับยั้งการเจริญของแบคทีเรียดังกล่าว (subinhibitory concentration)
ดังที่กล่าวไปในข้างต้นว่า การใช้ยาปฏิชีวนะที่ไม่เหมาะสมและไม่จำเป็นเพื่อการรักษาความเจ็บป่วยของมนุษย์ในปัจจุบันนั้นเป็นสาเหตุหลักที่ก่อให้เกิดภาวะฉุกเฉินด้านการดื้อยาของแบคทีเรีย โดยมากกว่าร้อยละ 50 ของการใช้ยาปฏิชีวนะในมนุษย์พบว่าเป็นการใช้ยาที่ไม่เหมาะสมและไม่ตรงตามข้อบ่งใช้ ยกตัวอย่างเช่น คน 1 ใน 3 คน ยังคงมีความเชื่อว่ายาปฏิชีวนะมีประสิทธิภาพในการรักษาโรคไข้หวัด โดยพบว่าการสั่งจ่ายยาปฏิชีวนะเพื่อรักษาโรคไข้หวัดนั้นพบเห็นได้มากที่สุดในประเด็นของการสั่งใช้ยาปฏิชีวนะที่ไม่ตรงตามข้อบ่งใช้ ถึงแม้จะเป็นที่ทราบกันดีของบุคลากรทางการแพทย์ว่ายาดังกล่าวไม่มีประสิทธิภาพในการต้านไวรัสที่เป็นสาเหตุของโรคไข้หวัด นอกจากนี้การใช้ยาปฏิชีวนะแม้เพียงครั้งเดียว ถึงแม้จะเป็นการใช้ในผู้ที่มีข้อบ่งใช้ที่จำเป็นต้องได้รับยาดังกล่าว ก็สามารถเพิ่มความเสี่ยงที่อาจก่อให้เกิดการดื้อยาปฏิชีวนะของแบคทีเรียได้ โดยความเสี่ยงที่เพิ่มขึ้นดังกล่าวจะคงอยู่ได้นานประมาณ 1 เดือน ถึง 1 ปี ตั้งแต่เริ่มมีการใช้ยาดังกล่าว
ความเสี่ยงที่จะเกิดการดื้อยาปฏิชีวนะของแบคทีเรียนั้นจะเพิ่มขึ้นตามระยะเวลาที่ใช้ยาปฏิชีวนะในการรักษา ดังนั้น ตราบใดที่ยังมีการใช้ยาปฏิชีวนะในจำนวนที่น้อยที่สุดที่ให้ประสิทธิภาพดีในการรักษา และใช้ยาดังกล่าวเป็นระยะเวลาที่สั้นที่สุดเท่าที่เป็นได้จะช่วยลดความเสี่ยงต่อการเกิดการดื้อยาของแบคทีเรีย ช่วยลดภาระค่าใช้จ่าย ให้ผลลัพธิ์การรักษาที่ดีกว่าและมีภาวะแทรกซ้อนน้อย .ทำให้ในปัจจุบันมีการใช้สูตรการรักษาด้วยยาปฏิชีวนะระยะสั้นในผู้ที่เจ็บป่วยด้วยโรคติดเชื้อแบคทีเรียหลายชนิด ได้แก่ โรคปอดอักเสบชุมชน (community-acquired pneumonia; CAP),เยื่อบุช่องท้องอักเสบเองจากแบคทีเรีย (spontaneous bacterial peritonitis; SBP), ผู้ป่วยหนักในหน่วยอภิบาลที่คาดว่าอาจมีการติดเชื้อแบคทีเรียในปอด, กลุ่มอาการที่เข้าได้กับอาการปวดท้องเฉียบพลัน (acute abdominal),หูชั้นกลางอักเสบ, โพรงอากาศอักเสบ และการติดเชอื้แบคทีเรียในช่องคอ (throat infection), และการเจ็บป่วยจากการทะลุของลำไส้ ในบางกรณี การรักษาด้วยยาปฏิชีวนะสูตรระยะสั้นอาจไม่สามารถรรักษาภาวะการติดเชื้อนั้น ๆ ได้ เช่นเดียวกันกับการรักษาด้วยยาปฏิชีวนะสูตรระยะยาว การศึกษาทางคลินิกที่ได้รับการตีพิมพ์ในวารสารทางการแพทย์ของสมาคมการแพทย์อังกฤษ (British Medical Association) พบว่า หากอาการและอาการแสดงของการติดเชื้อแบคทีเรียถูกกำจัดออกไปด้วยการรักษาด้วยยาปฏิชีวนะแล้ว ควรหยุดการบริหารยาดังกล่าว ณ 72 ชั่วโมงหลังอาการดีขึ้น ทั้งนี้ ส่วนใหญ่ผู้ป่วยมักมีอาการดีขึ้นก่อนที่เชื้อก่อโรคจะถูกกำจัดออกไปหมด ดังนั้นแพทย์ควรให้คำแนะนำแก่ผู้ป่วยทุกคนที่ได้รับการรักษาด้วยยาปฏิชีวนะให้ตระหนักรู้ถึงการได้รับการรักษาด้วยยาดังกล่าวจนถึงระยะเวลาที่แนะนำในแนวทางการรักษามาตรฐาน นักวิจัยบางคนสนับสนุนให้แพทย์ใช้หลักสูตรยาปฏิชีวนะที่สั้นมากในการรักษา และประเมินผู้ป่วยหลังจากนั้น 2–3 วันและหยุดการรักษาหากไม่มีอาการทางคลินิกที่บ่งบอกถึงการติดเชื้อแบคทีเรีย
นอกจากนี้ การใช้ยาปฏิชีวนะในกลุ่มที่แตกต่างกันพบว่ามีความสัมพันธ์กับการเกิดการดื้อยาหรือการแพร่กระจายของเชื้อบางสายพันธ์ที่มากกว่าการใช้ยาปฏิชีวนะในกลุ่มอื่น อาทิ อัตราการติดเชื้อสแตปฟิโลคอคคัส ออเรียสที่ดื้อต่อยาเมทิซิลลิน (Methicillin-resistant Staphylococcus aureus; MRSA) จะสูงขึ้นเมื่อมีการใช้ยาปฏิชีวนะกลุ่มไกลโคเปปไทด์ (Glycopeptide antibiotics), เซฟาโลสปอริน, และควิโนโลนเซฟาโลสปอริน และโดยเฉพาะควิโนโลนและคลินดามัยซินนั้นมีสามารถเหนี่ยวนำให้เกิดการเพิ่มจำนวนที่มากเกินปกติของแบคทีเรีย Clostridium difficile ในทางเดินอาหารได้
นอกเหนือจากปัจจัยดังข้างต้นแล้ว ปัจจัยบางประการที่จำเป็นต่อการรักษาผู้ป่วยในหน่วยอภิบาล (intensive care unit; ICU) อย่างการใส่เครื่องช่วยหายใจ (mechanical ventilation) และการมีโรคร่วมหลายโรค ก็เป็นปัจจัยเสริมที่เพิ่มความเสี่ยงต่อการติดเชื้อแบคทีเรียดื้อยาได้เช่นกัน รวมถึงการล้างมือและการทำให้ปราศจากเชื้อ (disinfecting) ที่ไม่ดีพอระหว่างการสัมผัสผู้ป่วยแต่ละคนของบุคลากรทางการแพทย์และเจ้าหน้าที่หอผู้ป่วยนั้นก็มีความสัมพันธ์กับการแพร่กระจายของจุลชีพดื้อยาเช่นกัน
การดื้อยาจากการใช้ยาปฏิชีวนะในสัตว์

ในช่วงหลายทศวรรษที่ผ่านมา เป็นที่สงสัยถึงความสัมพันธ์ระหว่างการใช้ยาปฏิชีวนะในการปศุสัตว์กับการเกิดการดื้อยาปฏิชีวนะของแบคทีเรีย จนกระทั่งองค์การอนามัยโลกได้ให้ข้อสรุปในประเด็นดังกล่าวว่า "การใช้ยาปฏิชีวนะที่ไม่เหมาะสมในการเลี้ยงสัตว์เป็นปัจจัยที่ส่งเสริมให้เกิดและการแพร่กระจายของเชื้อโรคที่ทนต่อยาปฏิชีวนะและควรห้ามไม่ให้มีการใช้ยาปฏิชีวนะเป็นตัวกระตุ้นการเจริญเติบโตในอาหารสัตว์"องค์การอนามัยโลกได้เพิ่มหลักเกณฑ์ด้านสุขอนามัยสัตว์บกเพื่อเป็นแนวทางในการให้คำแนะนำแก่สมาชิกขององค์กรในการสร้างและประสานการตรวจสอบและติดตามเฝ้าระวังการดื้อยาต้านจุลชีพระดับประเทศ, ติดตามตรวจสอบปริมาณยาปฏิชีวนะที่ใช้ในการเลี้ยงสัตว์, และให้คำแนะนำแก่องค์กรหรือหน่วยงานอื่น ๆ เพื่อให้มั่นใจว่ามีการใช้ยาปฏิชีวนะอย่างเหมาะสมและรอบคอบ ส่วนอีกแนวทางหนึ่งคือ การใช้วิธีการที่จะช่วยในการตรวจหาปัจจัยเสี่ยงที่เกี่ยวข้องกับการดื้อยา และประเมินความเสี่ยงนั้น ๆ ต่อการดื้อยาปฏิชีวนะของแบคทีเรีย
การดื้อยาโดยธรรมชาติ
การดื้อยาปฏิชีวนะของแบคทีเรียนั้นสามารถเกิดขึ้นได้เองทั่วไปในธรรมชาติ โดยมีการค้นพบยีนที่มีมาแต่โบราณซึ่งเป็นยีนทำให้แบคทีเรียเหล่านั้นดื้อต่อยาปฏิชีวนะ โดยยาปฏิชีวนะนั้นอาจเป็นยาที่ถูกผลิตขึ้นมาโดยแบคทีเรียนั้น ๆ ซึ่งยีนที่ทำให้เกิดการดื้อยาดังกล่าวเป็นที่รู้จักกันดีว่าเป็นรีซิสโตม (resistome) ที่พบการเกิดขึ้นได้เองในธรรมชาติ โดยยีนเหล่านั้นอาจถูกถ่ายทอดจากแบคทีเรียที่ไม่ก่อโรคไปยังแบคทีเรียอื่นที่ก่อโรคและทำให้แบคทีเรียที่ได้รับยีนนี้เข้าไปสามารถทนต่อยาปฏิชีวนะได้เช่นกัน
ใน ค.ศ. 1952 มีการค้นพบการดื้อยาเพนิซิลลินในแบคทีเรียบางสายพันธุ์ ซึ่งเป็นช่วงเวลาก่อนที่จะมีการนำยาดังกล่าวมาใช้ในทางคลินิก นอกจากนี้ยังมีการค้นพบว่ามีการดื้อยาสเตรปโตมัยซินของแบคทีเรียบางชนิดในช่วงเวลาก่อนหน้านั้นอีกด้วย ต่อมาใน ปี ค.ศ. 1962 ได้มีการตรวจพบเอนไซม์เพนิซิลิเนสในเอนโดสปอร์ของแบคทีเรีย Bacillus licheniformis ซึ่งเอนไซม์ดังกล่าวเป็นเอนไซม์ที่ทำลายโครงสร้างหลักของยากลุ่มเพนิซิลลิน จากดินแห้งบนรากพืชที่ถูกเก็บไว้ในพิพิธภัณฑ์บริติชตั้งแต่ปี ค.ศ. 1689 นอกจากนั้น การศึกษาจุลชีพในทางเดินอาหารของวิลเลียม เบรน (William Braine) และจอห์น ฮาร์ทเนลล์ (John Hartnell) ซึ่งเป็นลูกเรือที่เสียชีวิตในการเดินสำรวจมหาสมุทรอาร์กติกของจอห์น แฟรงคลิน (Franklin's lost expedition) พบแบคทีเรียสกุล Clostridium จำนวน 6 สเตรนที่ดื้อต่อเซโฟซิตินและคลินดามัยซิน
ทั้งนี้ การสร้างเอนไซม์เพนิซิลิเนสของแบคทีเรียนั้นอาจขึ้นอยู่กับบางสถานการณ์และสิ่งแวดล้อมด้วย โดยการหลั่งเอนไซม์นี้อาจเป็นผลมาจากการสร้างกลไกการป้องกันตนเองของแบคทีเรีนนั้น ๆ จากสภาพแวดล้อมในแหล่งที่อยู่ของตนที่เป็นอันตราย ยกตัวอย่างเช่น Staphylococcus aureus จะมีการสร้างเอนไซม์เพนิซิลิเนสออกมาเป็นจำนวนมากเมื่อต้องอาศัยอยู่ในแหล่งที่มีราตระกูลสกุลทริโคไฟตอนที่ผลิตเพนิซิลลิน ซึ่งส่งผลให้แบคทีเรียเกิดการดื้อต่อยาเพนิซิลลินได้ Search for a penicillinase ancestor has focused on the class of proteins that must be a priori capable of specific combination with penicillin. แต่ในทางกลับกัน การดื้อยาของแบคทีเรียที่พบในทางเดินอาหารของวิลเลียม เบรน และจอห์น ฮาร์ทเนลล์ ดังที่ได้กล่าวไว้ในข้างต้น อาจเป็นผลมาจากการที่ทั้งสองคนได้รับเชื้อแบคทีเรียที่สามารถสร้างเอนไซม์หรือเกิดการกลายพันธุ์แบบสุ่มของโครโมโซมได้เองตามธรรมชาติจนทำให้ทนต่อยาปฏิชีวนะดังกล่าวก็เป็นได้
นอกจากนี้ยังมีหลักฐานเชิงประจักษ์ที่บ่งชี้ได้ว่าโลหะหนัก และสารก่อมลพิษอื่น ๆ อาจมีส่วนในการทำให้เกิดการแพร่กระจายของแบคทีเรียดื้อยาได้โดยโลหะหนักและสารพิษเหล่านั้นจะทำให้แบคทีเรียที่ไม่ดื้อยาไม่สามารถดำรงชีวิตอยู่ได้ แต่ในทางตรงกันข้าม แบคทีเรียที่ดื้อยาจะไม่ได้รับผลกระทบดังกล่าวและจะมีการเพิ่มจำนวนมากขึ้นเพื่อทดแทนแบคทีเรียไม่ดื้อยาที่ลดจำนวนลงไป
การดื้อยาจากมลภาวะในสิ่งแวดล้อม
ปัญหาการดื้อต่อยาปฏิชีวนะของแบคทีเรียในปัจจุบันได้ทวีความรุนแรงมากขึ้นจนเป็นภัยคุกคามต่อสุขภาพทั้งมนุษย์และสัตว์ต่าง ๆ ไม่ว่าจะมีแหล่งอาศัยอยู่บนบกหรือในน้ำ โดยปัจจัยสำคัญอีกประการหนึ่งที่มีส่วนหนุนให้ปัญหาดังกล่าวแพร่กระจายจนส่งผลกระทบในวงกว้างก็คือ การปนเปื้อนและการแพร่กระจายของยาปฏิชีวนะหรือสารที่ออกฤทธิ์เป็นยาปฏิชีวนะในสิ่งแวดล้อม โดยเฉพาะอย่างยิ่ง น้ำเสียจากโรงพยาบาลและน้ำเสียจากชุมชนเมืองที่ถูกปล่อยออกสู่ธรรมชาติโดยไม่ได้รับการบำบัดหรือมีระบบการบำบัดที่ไม่รัดกุม ถือเป็นสาเหตุหลักที่ทำให้เกิดการปนเปื้อนดังกล่าวยาปฏิชีวนะได้ก่อให้เกิดมลพิษต่อสิ่งแวดล้อมนับตั้งแต่มีการนำมาใช้ในมนุษย์ (ยา, การเกษตร) ผ่านทางของเสียต่าง ๆ ที่ถูกขับออกจากร่างกายกมนุษย์ สัตว์เลี้ยง และของเสียจากอุตสาหกรรมยา การที่ของเสียที่มีการปนเปื้อนของยาปฏิชีวนะถูกปล่อยสู่สิ่งแวดล้อมโดยไม่ได้รับการบำบัดหรือได้รับการบำบัดที่ไม่ดีมาก จะเป็นปัจจัยเสริมให้เกิดการดื้อยาปฏิชีวนะของแบคทีเรียได้มากขึ้น และเกิดการปนเปื้อนและแพร่กระจายของแบคทีเรียดื้อยาดังกล่าวในสิ่งแวดล้อมนั้นอีกด้วย ในปี ค.ศ. 2011 การทำแผนที่ของตัวอย่างน้ำทิ้งและน้ำประปาในนิวเดลี ประเทศอินเดีย ซึ่งเป็นที่ทราบกันดีว่ามีจำนวนการใช้ยาปฏิชีวนะของประชาชนบริเวณนั้นในสัดส่วนที่สูง ผลการตรวจพบว่ามีการปนเปื้อนแบคทีเรียอยู่เป็นจำนวนมากและยังส่งผลให้เกิดการติดเชื้อแบคทีเรียในทางเดินอาหารในชุมชนที่อุปโภคบริโภคน้ำจากแหล่งดังกล่าวอย่างเป็นวงกว้างและยากแก่การควบคุมโรค โดยพบว่าเชื้อก่อโรคดังกล่าวส่วนใหญ่มักมีผลตรวจเอนไซม์ NDM-1 เป็นบวก ซึ่งเป็นเอนไซม์ดังกล่าวจะส่งผลให้แบคทีเรียนั้น ๆ เกิดการดื้อต่อยาที่มีโครงสร้างหลักเป็นวงบีตา-แลคแตมได้หลายชนิด ซึ่งโดยทั่วไปแล้ว ร้อยละ 70–80 ของผู้ปวยที่มีอาการท้องร่วงมักมีสาเหตุมาจากการติดเชื้อไวรัส ซึ่งไม่สามารถรักษาได้โดยการใช้ยาปฏิชีวนะ แต่ในการข้อมูลจากการศึกษากลับพบว่าราวร้อยละ 40 ของผู้ป่วยที่มีอาการข้างต้นยังคงพยายามที่จะรักษาอาการท้องร่วงนั้นด้วยยาปฏิชีวนะ ในบางพื้นที่ผู้ที่รักษาอาการท้องร่วงอย่างไม่เหมาะสมด้วยยาปฏิชีวนะนั้นมีสัดส่วนที่มากถึงร้อยละ 80
เนื่องจากแบคทีเรียเป็นสิ่งมีชีวิตที่สามารถแบ่งเซลล์เพื่อเพิ่มจำนวนได้อย่างรวดเร็ว ทำให้แบคทีเรียดื้อยาที่แพร่กระจายลงสู่สิ่งแวดล้อมนั้นสามารถเจริญเติบโตและแพร่จำนวนได้มากภายในระยะเวลาอันสั้น ยิ่งไปกว่านั้น แบคทีเรียที่ดื้อยาเหล่านี้ยังสามารถถ่ายทอดยีนดื้อยาไปยังแบคทีเรียสายพันธุ์หรือสเตรนอื่น ๆ ได้ผ่านกระบวนการที่เรียกว่า การถ่ายทอดยีนในแนวราบ (horizontal gene transfer; HGT) ดังนั้น ถึงแม้ว่ายาปฏิชีวนะที่แบคทีเรียดังกล่าวดื้อยาจะไม่ถูกปล่อยลงสู่ธรรมชาติเพิ่มเติมในอนาคต ยีนที่ดื้อยาปฏิชีวนะดังกล่าวก็จะยังคงพบเห็นอยู่ในแบคทีเรียธรรมชาติทั่วไป เนื่องจากแบคทีเรียดังกล่าวจะมีการแบ่งตัวและถ่ายทอดยีนดื้อยาให้กันจากรุ่นสู่รุ่น นอกจากนี้ยังพบว่า มีการแพร่กระจายเป็นวงกว้างของแบคทีเรียดื้อยาในสัตว์ทะเลที่มีกระดูกสันหลัง ซึ่งเป็นที่คาดการณ์กันว่าแบคทีเรียดื้อยาที่พบเหล่านี้อาจเป็นแหล่งสำคัญที่จะทำให้เกิดการแพร่กระจายของเชื้อดื้อยาในสิ่งแวดล้อมทางทะเล
การป้องกัน
ในปัจจุบัน มีการเรียกร้องให้มีมาตรการจัดการกับปัญหาการดื้อยาปฏิชีวนะของแบคทีเรียที่มีอุบัติการณ์และความรุนแรงเพิ่มมากขึ้น ซึ่งรวมไปถึงการร่างสนธิสัญญาระหว่างประเทศเพื่อแก้ปัญหาด้านการดื้อยาของจุลชีพ อย่างไรก็ตาม การดำเนินงานนี้จำเป็นต้องมีรายละเอียดและได้รับความสนใจจากภาคส่วนต่าง ๆ มากขึ้นเพื่อที่จะประมาณการและวัดแนวโน้มความรุนแรงของปัญหาดังกล่าวในระดับนานาชาติ โดยที่ผ่านมามีแนวคิดที่จะนำระบบการติดตามและประเมินผลการรักษา (tracking system) มาใช้จัดการกับปัญหานี้ แต่การใช้งานจริงนั้นยังไม่อาจเกิดขึ้นได้มากเท่าใดนัก ซึ่งระบบในลักษณะนี้จะให้ข้อมูลเชิงลึกแก่พื้นที่ที่มีการดื้อยาสูง รวมถึงข้อมูลที่จำเป็นสำหรับการประเมินการดำเนินงานและการเปลี่ยนแปลงอื่น ๆ ที่ทำขึ้นเพื่อต่อสู้หรือจัดการกับปัญหาการทนต่อยาปฏิชีวนะของแบคทีเรีย โดยกลยุทธิ์สำคัญ 5 ประการที่จำเป็นสำหรับการลดการเกิดการดื้อยาของแบคทีเรีย ได้แก่
- มีการเฝ้าระวังการใช้ยาปฏิชีวนะ เพื่อสงวนยาปฏิชีวนะที่มีอยู่ในปัจจุบันและที่อาจค้นพบใหม่ในอนาคตให้มีประสิทธิภาพในการรักษาโรคติดเชื้อแบคทีเรียต่าง ๆ ได้ดีเหมือนที่ผ่านมา
- มีการกำหนดกรอบเวลาที่จำเป็นต้องมีการสั่งจ่ายยาปฏิชีวนะที่มีประสิทธิภาพและเจาะจงกับเชื้อสาเหตุให้เร็วที่สุดเท่าที่เป็นไปได้
- พัฒนาและรับรองยาปฏิชีวนะชนิดใหม่ให้ได้ 10 ชนิดภายในปี ค.ศ. 2020
- พัฒนาวิธีการศึกษาพันธุศาสตร์ระดับโมเลกุลเพื่อตรวจหายีนของแบคทีเรียที่ก่อให้เกิดการดื้อยาปฏิชีวนะ
- ไม่ก่อให้เกิดความล่าช้าในขั้นตอนการกระจายงบประมาณเพื่อกองทุนนวัตกรรมต้านการดื้อยาของแบคทีเรียมูลค่า 2 พันล้านเหรียญสหรัฐ
ระยะเวลาการใช้ยาปฏิชีวนะ
ระยะเวลาที่ใช้สำหรับการรักษาโรคติดเชื้อแบคทีเรียด้วยยาปฏิชีวนะนั้นจะขึ้นอยู่กับชนิดของโรคและปัญหาด้านสุขภาพอื่น ๆ ของผู้ป่วยแต่ละราย การหยุดการรักษาด้วยยาปฏิชีวนะหลังจากผู้ป่วยมีอาการดีขึ้นโดยที่ไม่ได้รับยาปฏิชีวนะครบตามกรอบระยะเวลาที่กำหนดในแบบแผนการรักษานั้น มีหลักฐานเชิงประจักษ์บางแหล่งที่พบว่า การเกิดการดื้อยาปฏิชีวนะของแบคทีเรียจะเกิดขึ้นได้มากกว่าปกติในกรณีดังกล่าว แต่ข้อมูลบางแหล่งก็ระบุไปในอีกทิศทางหนึ่งว่า การหยุดการรักษาด้วยยาปฏิชีวนะเร็วกว่าปกตินั้นอาจเป็นการกระทำที่สมเหตุสมผลได้ในผู้ป่วยบางราย แต่ผู้ป่วยโรคติดเชื้อบางชนิดจำเป็นที่จะต้องได้รับการรักษาด้วยยาปฏิชีวนะเป็นระยะเวลานาน การพิจารณาหยุดการใช้ยาในผู้ป่วยดังกล่าวไม่ได้ขึ้นอยู่กับว่าผู้ป่วยจะมีอาการดีขึ้นหรือไม่ก็ตาม
การติดตามและวางผังงาน
การจำกัดการใช้ยาปฏิชีวนะ
ระดับโรงพยาบาล
ระดับบุคลากร
ระดับประชาชน
สุขาภิบาลและการอนามัย
การจัดการการใช้ยาปฏิชีวนะในสัตว์
ยุโรป
สหรัฐอเมริกา
การวางแผนปฏิบัติงานและสร้างความตระหนักในระดับนานาชาติ
“สัปดาห์รู้รักษ์ ตระหนักใช้ยาปฏิชีวนะ
กลไกการดื้อยา
ประวัติ และประเด็นด้านสังคมและวัฒนธรรม
การศึกษาวิจัย
สถานการณ์แบคทีเรียดื้อยาในประเทศไทย
ดูเพิ่ม
|
คอมมอนส์ มีภาพและสื่อเกี่ยวกับ: แบคทีเรียดื้อยา |
บรรณานุกรม
หนังสือ
-
Caldwell, Roy; Lindberg, David, บ.ก. (2011). "Understanding Evolution" [Mutations are random]. University of California Museum of Paleontology.
{{cite web}}:|ref=harvไม่ถูกต้อง (help) -
Reynolds, edited by L.A; Tansey, E.M. (2008). Superbugs and superdrugs : a history of MRSA : the transcript of a Witness Seminar held by the Wellcome Trust Centre for the History of Medicine at UCL, London, on 11 July 2006. London: Wellcome Trust Centre for the History of Medicine at UCL. ISBN 978-0-85484-114-1.
{{cite book}}:|first1=มีชื่อเรียกทั่วไป (help)
วารสาร
-
Arias CA, Murray BE (2009). "Antibiotic-Resistant Bugs in the 21st Century — A Clinical Super-Challenge". New England Journal of Medicine. 360 (5): 439–443. doi:10.1056/NEJMp0804651. PMID 19179312.
{{cite journal}}:|ref=harvไม่ถูกต้อง (help)CS1 maint: uses authors parameter (ลิงก์) -
Goossens H, Ferech M, Vander Stichele R, Elseviers M (2005). Esac Project. "Outpatient antibiotic use in Europe and association with resistance: a cross-national database study". Lancet. Group Esac Project. 365 (9459): 579–87. doi:10.1016/S0140-6736(05)17907-0. PMID 15708101.
{{cite journal}}:|ref=harvไม่ถูกต้อง (help)CS1 maint: others (ลิงก์) CS1 maint: uses authors parameter (ลิงก์) -
Hawkey, PM; Jones, AM (September 2009). "The changing epidemiology of resistance". The Journal of antimicrobial chemotherapy. 64 Suppl 1: i3–10. doi:10.1093/jac/dkp256. PMID 19675017.
{{cite journal}}:|ref=harvไม่ถูกต้อง (help) -
Soulsby EJ (2005). "Resistance to antimicrobials in humans and animals: Overusing antibiotics is not the only cause and reducing use is not the only solution". British Medical Journal. 331 (7527): 1219–20. doi:10.1136/bmj.331.7527.1219. PMC 1289307. PMID 16308360.
{{cite journal}}:|ref=harvไม่ถูกต้อง (help) -
"Alternatives to Antibiotics Reduce Animal Disease". Commonwealth Scientific and Industrial Research Organization. 9 Jan 2006. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2011-06-05. สืบค้นเมื่อ 2018-02-20.
{{cite journal}}:|ref=harvไม่ถูกต้อง (help) - Cooke, Paul; Rees-Roberts, Dominic (2017). CATCH. 16-minute film about a post-antibiotic world. Review: Sansom, Clare (March 2017). "Media Watch: An intimate family story in a world without antibiotics". Lancet Infect Dis. 17 (3): 274. doi:10.1016/S1473-3099(17)30067-1.
แหล่งข้อมูลอื่น
- แบคทีเรียดื้อยา ที่เว็บไซต์ Curlie (ภาษาอังกฤษ)
- แอนิเมชันเกี่ยวกับจุลชีพดื้อยา (ภาษาอังกฤษ)
- "แนวทางการจัดการโรคที่เกิดจากการติดเชื้อจุลชีพดื้อยาหลายขนานในสถานพยาบาล 2006" ของศูนย์ควบคุมและป้องกันโรค ประเทศสหรัฐอเมริกา (ภาษาอังกฤษ)
- โครงการการเฝ้าระวังการใช้ยาต้านจุลชีพ, ศูนย์วิจัยและนโยบายด้านโรคติดต่อ (Center for Infectious Disease Research and Policy; CIDRAP), มหาวิทยาลัยมินนิโซตา (ภาษาอังกฤษ)
- พันธมิตรอุตสาหกรรมด้านการดื้อยาของจุลชีพ (AMR Industry Alliance), ประกอบด้วยสมาชิกจากบริษัทขนาดใหญ่ที่ดำเนินกิจการด้านการวิจัยและพัฒนายา โรงงานยา บริษัทด้านเทคโนโลยีชีวภาพ และบริษัที่เกี่ยวเนื่องกับงานด้านการวินิจฉัยโรคติดเชื้อ (ภาษาอังกฤษ)
|
ยาต้านจุลชีพ − ประเด็นด้านสังคมและวัฒนธรรม
| |
|---|---|
| ประเภทของยาต้านจุลชีพ | |
| ประเด็นด้านสังคม | |
| เภสัชวิทยา | |
| เภสัชจลนศาสตร์ | |
|---|---|
| เภสัชพลศาสตร์ | |
| อะโกนิสต์และแอนตาโกนิสต์ | |
| อื่นๆ | |
| บทความที่เกี่ยวข้อง | |