ไลนิโซลิด
 | |
 | |
| ข้อมูลทางคลินิก | |
|---|---|
| การอ่านออกเสียง | /lɪˈnɛzəlɪd/ li-nez-ə-lid, /lɪˈneɪzəlɪd/ |
| ชื่อทางการค้า | Zyvox, Zyvoxid, และอื่นๆ |
| AHFS/Drugs.com | โมโนกราฟ |
| MedlinePlus | a602004 |
| ข้อมูลทะเบียนยา | |
| ระดับความเสี่ยงต่อทารกในครรภ์ | |
| ช่องทางการรับยา | ฉีดเข้าหลอดเลือดดำ, รับประทาน |
| รหัส ATC | |
| กฏหมาย | |
| สถานะตามกฏหมาย | |
| ข้อมูลเภสัชจลนศาสตร์ | |
| ชีวประสิทธิผล | ~100% (รับประทาน) |
| การจับกับโปรตีน | ต่ำ (31%) |
| การเปลี่ยนแปลงยา | ตับ 50–70%, CYP ไม่มีผล |
| ครึ่งชีวิตทางชีวภาพ | 4.2–5.4 ชั่วโมง (อาจสั้นลงในเด็ก) |
| การขับออก | ไต, และอุจจาระ |
| ตัวบ่งชี้ | |
| |
| เลขทะเบียน CAS | |
| PubChem CID | |
| DrugBank |
|
| ChemSpider |
|
| UNII | |
| KEGG |
|
| ChEMBL | |
| NIAID ChemDB | |
| ECHA InfoCard | 100.121.520 |
| ข้อมูลทางกายภาพและเคมี | |
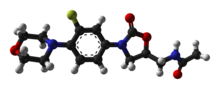
| สูตร | C16H20FN3O4 |
| มวลต่อโมล | 337.346 g/mol |
| แบบจำลอง 3D (JSmol) | |
| |
|
| |
ไลนิโซลิด (อังกฤษ: Linezolid) เป็นยาปฏิชีวนะชนิดหนึ่งที่ใช้ในการรักษาโรคติดเชื้อที่มีสาเหตุมาจากเชื้อแบคทีเรียกรัมบวกที่ดื้อต่อยาปฏิชีวนะชนิดอื่น ไลนิโซลิดสามารถออกฤทธิ์ฆ่าเชื้อแบคทีเรียกรัมบวกได้เกือบทุกสายพันธ์ รวมถึงเชื้อแบคทีเรียในสกุลสเตรปโตคอกคัส (Streptococcus), สกุลเอนเทอโรคอคคัสที่ดื้อต่อยาแวนโคมัยซิน (Vancomycin-resistant Enterococcus; VRE), และเชื้อสแตปฟิโลคอคคัส ออเรียสที่ดื้อต่อยาเมทิซิลลิน (Methicillin-resistant Staphylococcus aureus; MRSA) ส่วนมากแล้วมักใช้ยานี้ในการรักษาโรคติดเชื้อดังข้างต้นบริเวณผิวหนังและในปอด อย่างไรก็ตาม ยานี้อาจถูกใช้ในโรคติดเชื้อแบคทีเรียอื่นได้เช่นกัน เช่น วัณโรคที่ดื้อต่อยารักษาวัณโรคสูตรปกติ โดยยานี้สามารถบริหารยาได้ทั้งการฉีดเข้าหลอดเลือดดำ (intravenous) และการรับประทาน
การใช้ยาไลนิโซลิดในระยะเวลาสั้นนั้นมีความปลอดภัยค่อนข้างสูง ทั้งในกลุ่มผู้ป่วยปกติ และผู้ป่วยที่มีภาวะไตวายเรื้อรัง หรือโรคตับอักเสบ อาการไม่พึงประสงค์ทั่วไปที่อาจเกิดขึ้นกับผู้ป่วยที่ได้รับยานี้ในช่วงสั้น ได้แก่ ปวดศีรษะ, ท้องเสีย, ผื่น, และอาเจียน ส่วนอาการไม่พึงประสงค์ที่รุนแรงที่อาจเกิดขึ้นได้ในผู้ป่วยบางราย ได้แก่ กลุ่มอาการเซโรโทนิน (Serotonin syndrome), การกดไขกระดูก (Bone marrow suppression) และภาวะเลือดเป็นกรดแล็กติก (lactic acidosis) โดยความเสี่ยงต่อการเกิดอาการไม่พึงประสงค์ที่รุนแรงจะเพิ่มมากขึ้นอย่างมีนัยยะเมื่อใช้ยาไลนิโซลิดต่อเนื่องกันเป็นระยะเวลานานมากกว่า 2 สัปดาห์ ในบางครั้งการใช้ยานี้ต่อเนื่องเป็นระยะเวลานานอาจทำให้เกิดการทำลายเส้นประสาทส่วนปลายจนไม่สามารถฟื้นฟูกลับคืนสภาพเดิมได้ ซึ่งรวมถึงการทำลายเส้นประสาทที่ควบคุมการทำงานของการมองเห็นด้วย
ไลนิโซลิดเป็นยาปฏิชีวนะอีกชนิดหนึ่งในยากลุ่มออกซาโซลิโดน (Oxazolidone) เนื่องจากยาดังกล่าวมีคุณสมบัติในการยับยั้งการสังเคราะห์โปรตีนของแบคทีเรีย ทำให้ยาดังกล่าวสามารถยับยั้งการเจริญเติบโตและฆ่าเชื้อแบคทีเรียได้ อย่างไรก็ตาม ถึงแม้ว่าในปัจจุบันจะมีนาปฏิชีวนะหลายชนิดที่ออกฤทธิ์ยับยั้งการสร้างโปรตีนของเชื้อแบคทีเรียได้เหมือนกับไลนิโซลิด แต่โดยแท้จริงแล้ว ไลนิโซลิดนั้นมีกลไกการออกฤทธิ์ที่แตกต่างไปจากยาปฏิชีวนะชนิดอื่น กล่าวคือ ยาดังกล่าวจะไปออกฤทธิ์ยับยั้งขั้นตอนแรกในการสร้างโปรตีน ในขณะที่ยาปฏิชีวนะอื่นนั้นจะออกฤทธิ์ในขั้นตอนที่เป็นลำดับถัดมา ด้วยกลไกการออกฤทธิ์ที่แตกต่างจากยาปฏิชีวนะชนิดอื่นนี้ ทำให้อุบัติการณ์การดื้อต่อยาไลนิโซลิดของเชื้อแบคทีเรียในปัจจุบันยังอยู่ในระดับที่ค่อนข้างต่ำ (ข้อมูล ปี ค.ศ. 2014)
ไลนิโซลิดถูกค้นพบในช่วงกลางทศวรรต 1990 และได้รับการรับรองให้มีการผลิตเชิงการค้าในปี ค.ศ. 2000 โดยถือเป็นหนึ่งในรายการยาที่จำเป็นขององค์การอนามัยโลก (World Health Organization's List of Essential Medicines) ซึ่งเป็นรายการยาที่มีความสำคัญเป็นลำดับแรกของระบบสุขภาพพื้นฐานของประชาชนในประเทศต่างๆ ไลเน็กโซลิด (Linexolid) ถือเป็นชื่อการค้าแรกของยานี้ โดยต้นทุนยาในการรักษาผู้ป่วยในประเทศกำลังพัฒนาด้วยยานี้มีมูลค่าประมาณ 13.40 US$ ต่อวัน ขณะที่ในสหรัฐอเมริกา จากข้อมูลในปี ค.ศ. 2016 มีมูลค่าประมาณ 13.79 US$ ต่อวัน จากการเปรียบเทียบต้นทุน-ประสิทธิผล (Cost-effectiveness analysis; CEA) พบว่าไลนิโซลิดมีความคุ้มค่ามากกว่ายาต้านเชื้อแบคทีเรียดื้อยาทางเลือกชนิดอื่นอย่างแวนโคมัยซิน (Vancomycin) อย่างมีนัยสำคัญ ทั้งนี้เนื่องจากการใช้ยาไลนิโซลิดนั้นสามารถปรับเปลี่ยนจากการบริหารยาโดยการฉีดเข้าหลอดเลือดดำมาเป็นการรับประทานได้เร็วกว่า ทำให้มีต้นทุนในการรักษาที่ต่ำกว่า
การใช้ประโยชน์ทางการแพทย์
โดยส่วนใหญ่แล้ว ไลนิโซลิดมักจะถูกนำมาใช้รักษาในกรณีที่เป็นโรคติดเชื้อแบคทีเรียที่มีอาการของโรครุนแรงและมีสาเหตุมาจากเชื้อแบคทีเรียกรัมบวกที่ดื้อยาปฏิชีวะชนิดอื่นๆ แต่ไม่ควรใช้ไลนิโซลิดในการรักษาโรคติดเชื้อแบคทีเรียที่มีสาเหตุมาจากเชื้อที่ยังคงมีความไวต่อยาปฏิชีวนะกลุ่มขอบเขตการรักษาแคบ (Narrow spectrum) อย่างยากลุ่มเพนิซิลลิน และกลุ่มเซฟาโลสปอริน ทั้งในสื่อสิ่งพิมพ์และเอกสารทางวิทยาศาสตร์ต่างก็ล้วนยกให้ไลนิโซลิดเป็น "ยาปฏิชีวนะที่ถูกสงวนไว้" (reserve antibiotic) กล่าวคือ ยาดังกล่าวจะถูกนำมาใช้ในกรณีที่จำเป็นเท่านั้น โดยจะจัดเป็น “ยาที่ถูกเลือกใช้เป็นอันดับสุดท้าย” (Drug of last resort) เพื่อใช้ในกรณีที่ภาวะติดเชื้อนั้นไม่สามารถบำบัดรักษาได้ด้วยยาปฏิชีวนะชนิดอื่น หรือเฉพาะโรคที่เกิดจากการติดเชื้อแบคทีเรียที่ดื้อต่อยาปฏิชีวนะหลายขนาน
ในประเทศสหรัฐอเมริกา ยาไลนิโซลิดได้รับการรับรองจากองค์การอาหารและยาแห่งสหรัฐอเมริกา (U.S. Food and Drug Administration; FDA) เพื่อให้ใช้ในการบำบัดรักษาโรคติดเชื้อที่เกิดจากการติดเชื้อแบคทีเรียเอนเทอโรคอคคัส ฟีเซียม ที่ดื้อต่อยาแวนโคมัยซิน (Vancomycin-resistant Enterococcus faecium) ทั้งในกรณีที่มีการแพร่กระจายและไม่มีการแพร่กระจายของเชื้อดังกล่าวไปสู่กระแสเลือด, โรคปอดอักเสบจากการติดเชื้อในโรงพยาบาล (Nosocomial pneumonia หรือ hospital-acquired pneumonia) ที่มีสาเหตุมาจากการติดเชื้อแบคทีเรียสแตปฟิโลคอคคัส ออเรียส (Staphylococcus aureus) และสเตรปโตคอคคัส นิวโมเนียอี (Staphylococcus pneumoniae), การติดเชื้อแบคทีเรียที่ผิวหนังและโครงสร้างผิวหนังอย่างรุนแรง (Complicated skin and skin structure infections; cSSSI) ที่มีสาเหตุมาจากการติดเชื้อแบคทีเรียที่ยังไวต่อไลนิโซลิด ซึ่งรวมไปถึงแผลติดเชื้อที่เท้าของโรคเบาหวาน (diabetic foot infection) ยกเว้นการติดเชื้อที่กระดูกและไขกระดูก (osteomyelitis) ที่รุนแรง, และการติดเชื้อแบคทีเรียที่ผิวหนังและโครงสร้างผิวหนังที่ไม่รุนแรง ซึ่งมีสาเหตุมาจากการติดเชื้อแบคทีเรียสเตรปโตค็อกคัส ไพโอจีนัส (Streptococcus pyogenes) และสแตปฟิโลคอคคัส ออเรียส (S. aureua) ทั้งนี้ บริษัทผู้ผลิตไม่แนะนำให้ใช้ยาดังกล่าวสำหรับการรักษาภาวะปอดอักเสบชุมชน (Community-acquired pneumonia; CAP) หรือการติดเชื้อที่กระดูกหรือเนื้อเยื่ออ่อนที่ไม่รุนแรง (Uncomplicated skin and soft tissue infections; cSSIIs) ถึงแม้ว่าจะมีเชื้อ MRSA เป็นเชื้อสาเหตุก็ตาม แต่สำหรับในสหราชอาณาจักรนั้น มีเพียงภาวะปอดอักเสบและการติดเชื้อที่กระดูกหรือเนื้อเยื่ออ่อนที่ไม่รุนแรงเท่านั้นที่ถือเป็นข้อบ่งใช้ถูกกำหนดให้ระบุไว้บนเอกสารกำกับยาของไลนิโซลิด
ทั้งนี้ การใช้ไลนิโซลิดในเด็กและทารกนั้นมีความปลอดภัยในระดับเดียวกันกับการใช้ยาดังกล่าวในผู้ใหญ่
การติดเชื้อในกระดูกและเนื้อเยื่ออ่อน
การศึกษาโดยการวิเคราะห์อภิมาน (Meta-analysis) จากข้อมูลต่างๆที่ได้จากการศึกษาทดลองแบบสุ่มและมีกลุ่มควบคุม (Randomized controlled trials; RCTs) หลายการศึกษา พบว่า ไลนิโซลิดมีประสิทธิภาพมากกว่ายาปฏิชีวนะกลุ่มไกลโคเปปไทด์ (Glycopeptide antibiotics) อย่างแวนโคมัยซินและไทโคพลานิน รวมไปถึงยาปฏิชีวนะกลุ่มเบต้า-แลคแตม (β-lactam antibiotics) ในการรักษาการติดเชื้อในกระดูกและเนื้อเยื่ออ่อนที่มีสาเหตุมาจากเชื้อแบคทีเรียกรัมบวก และมีการศึกษาขนาดเล็กหลายการศึกษาที่ให้ผลการศึกษายืนยันถึงประสิทธิภาพของไลเนโซลิตในการรักษาภาวะติดเชื้อแบคทีเรียกรัมบวกที่รุนแรงทุกชนิดที่เหนือกว่าไทโคพลานิน
ในการรักษาแผลติดเชื้อที่เท้าจากโรคเบาหวาน (diabetic foot infections) นั้น การใช้ไลนิโซลิดจะมีราคาต้นทุนน้อยกว่าแต่กลับมีประสิทธิภาพในการรักษามากกว่าแวนโคมัยซิน ในปี ค.ศ. 2004 ผลการศึกษาของการศึกษาแบบเปิด (Open-label study) พบว่า ไลนิโซลิดมีประสิทธิภาพเทียบเท่ากับแอมพิซิลลิน/ซัลแบคแตม (Ampicillin/sulbactam) และอะม็อกซีซิลลิน/กรดคลาวูลานิค (Amoxicillin/clavulanic acid) และมีประสิทธิภาพการรักษาเหนือกกว่าเป็นอย่างมากในการรักษาผู้ป่วยแผลติดเชื้อที่เท้าจากโรคเบาหวานที่ไม่มีกระดูกอักเสบติดเชื้อ (Osteomyelitis) ร่วมด้วย อย่างไรก็ตาม การใช้ไลนิโซลิดนั้นมีอัตราการเกิดอาการไม่พึงประสงค์จากยาได้มากกว่าอย่างมีนัยสำคัญทางสถิติ อย่างไรก็ตาม การศึกษาแบบการวิเคราะห์อภิมานในปี ค.ศ. 2008 ซึ่งใช้ผลลัพธ์ที่ได้จากการศึกษาทดลองแบบสุ่มและมีกลุ่มควบคุมจำนวน 18 การศึกษามาวิเคราะห์ พบว่า การใช้ไลนิโซลิดสำหรับข้อบ่งใช้นี้นั้นเกิดความล้มเหลวในการรักษาได้ไม่แตกต่างไปจากยาปฏิชีวนะชนิดอื่น ไม่ว่าผู้ป่วยจะมีภาวะกระดูกอักเสบติดเชื้อร่วมด้วยหรือไม่ก็ตาม
ทั้งนี้ นักวิจัยบางท่านได้ให้คำแนะนำเพิ่มเติมว่า ควรใช้ยาปฏิชีวนะชนิดอื่นที่มีราคาถูกกว่าและมีต้นทุนประสิทธิผลสูง 2 ชนิดร่วมกันก่อน เช่น ไตรเมโธพริม/ซัลฟาเมธอกซาโซล (Trimethoprim/sulfamethoxazole) กับไรแฟมพิซิน หรือคลินดามัยซิน อย่างใดอย่างหนึ่ง ก่อนที่จะมีการใช้ไลนิโซลิดในการรักษาการติดเชื้อในกระดูกและเนื้อเยื่ออ่อน โดยอิงตามผลการทดสอบความไวของเชื้อสาเหตุต่อยาปฏิชีวนะชนิดต่างๆ
ภาวะปอดอักเสบ
ผลการศึกษาทางคลินิกในปี ค.ศ. 2008 พบว่า ความสำเร็จในการรักษาภาวะปอดอักเสบด้วยไลนิโซลิดกับยาปฏิชีวนะอื่น ได้แก่ ยาปฏิชีวนะกลุ่มไกลโคเปปไทด์และยาปฏิชีวนะกลุ่มเบต้า-แลคแตม ไม่มีความแตกต่างกันจนถึงระดับที่มีนัยสำคัญทางสถิติ แนวทางการรักษาโรคปอดอักเสบชุมชนของสมาคมโรคทรวงอกแห่งประเทศสหรัฐอเมริกา (American Thoracic Society; ATS) และสมาคมโรคติดเชื้อแห่งสหรัฐอเมริกา. (Infectious Diseases Society of America; IDSA) ได้ให้คำแนะนำว่า ควรสงวนไลนิโซลิดไว้ใช้ในกรณีที่มีผลกาตรวจเพาะเชื้อยืนยันแล้วว่าเชื้อสาเหตุที่ก่อให้เกิดโรคนั้น คือ MRSA หรืออาการแสดงทางคลินิกที่อาจเข้าได้กับการติดเชื้อ MRSA ทั้งนี้ แนวทางการรักษาของสมาคมโรคทรวงอกแห่งสหราชอาณาจักร (British Thoracic Society; BTS) ไม่แนะนำให้ใช้ไลนิโซลิดเป็นทางเลือกแรกในการรักษา ถึงแม้ว่าเชื้อสาเหตุจะเป็นเชื้อ MRSA ก็ตาม โดยแนะนำให้ใช้ไลนิโซลิดเป็นทางเลือกรองรองจากแวนโคมัยซินเท่านั้น อย่างไรก็ตาม ไลนิโซลิดสามารถใช้ในการรักษาโรคปอดอักเสบชุมชนได้ในกรณีที่เชื้อสาเหตุมีการดื้อต่อยากลุ่มเพนนิซิลลิน
แนวทางการรักษาของประเทศสหรัฐอเมริกานั้นสามารถใช้ได้ทั้งไลเนโวลิดและแวนโคมัยซินอย่างใดอย่างหนึ่งเป็นการรักษาทางเลือกแรกในการรักษาโรคปอดออักเสบในโรงพยาบาลที่มีสาเหตุมาจากการติดเชื้อ MRSA (Hospital-acquired MRSA pneumonia) อย่างไรก็ตาม ผลการศึกษาทางคลินิกบางการศึกษาพบว่า ไลนิโซลิดนั้นมีประสิทธิภาพในการรักษาโรคปอดออักเสบในโรงพยาบาลดังข้างต้นได้ดีกว่าแวนโคมัยซิน
อื่นๆ

เป็นที่เชื่อกันโดยทั่วไปว่าการติดเชื้อแบคทีเรียชนิดที่เรียกกันว่า การติดเชื้อแบคทีเรียที่ชั้นลึก (deep infections) เช่น การติดเชื้อแบคทีเรียที่กระดูกและไขกระดูก (osteomyelitis), การติดเชื้อที่เยื่อบุหัวใจ ควรได้รับการรักษาด้วยยาปฏิชีวนะที่ออกฤทธิ์ฆ่าเชื้อแบคทีเรีย (Bacteriocidal antibiotics) และไม่ควรใช้ยาปฏิชีวนะชนิดที่ออกฤทธิ์เฉพาะยับยั้งการเจริญเติบโตของเชื้อเท่านั้น (Bacteriostatic antibiotics) ถึงกระนั้น การศึกษาในขั้นก่อนการทดสอบในมนุษย์ (preclinical study) หลายการศึกษาได้ทำการประเมินถึงประสิทธิภาพของไลนิโซลิดต่อการรักษาภาวะการติดเชื้อแบคทีเรียดังข้างต้น ในท้ายที่สุดพบว่ายาดังกล่าวสามารถรักษาภาวะการติดเชื้อข้างต้นได้ในมนุษย์ ทั้งนี้ ดูเหมือนว่าไลนิโซลิดจะเป็นตัวเลือกในการรักษาที่สมเหตุสมผลในภาวะการติดเชื้อที่เยื่อบุหัวใจที่มีสาเหตุมาจากเชื้อแบคทีเรียกรัมบวกที่ดื้อต่อยาปฏิชีวนะหลายชนิด แต่ก็ยังไม่มีหลักฐานเชิงประจักษ์คุณภาพสูงมาสนับสนุนการใช้ยานี้สำหรับข้อบ่งใช้ดังกล่าว ทำให้การรักษาการติดเชื้อที่เยื่อบุหัวใจที่มีสาเหตุมาจากเชื้อแบคทีเรียกลุ่มเอนเทอโรคอคคัส (enterococcal endocarditis) มีความหลากหลายเป็นอย่างมากในปัจจุบัน ซึ่งในบางกรณีอาจประสบผลสำเร็จในการรักษา ในทางตรงกันข้าม บางกรณีกลับไม่ตอบสนองต่อการรักษา หลักฐานเชิงประจักษ์ทางการแพทย์คุณภาพต่ำถึงปานกลางหลายการศึกษาได้มีการใช้ยาไลนิโซลิดในการรักษาการติดเชื้อที่กระดูกและข้อเพิ่มมากขึ้น รวมไปถึง การติดเชื้อแบคทีเรียที่กระดูกและไขกระดูกเรื้อรัง (chronic osteomyelitis) ถึงแม้ว่าจะมีความกังวลเกี่ยวกับอาการไม่พึงประสงค์จากยาดังกล่าวเมื่อมีการใช้ในการรักษาระยะยาวก็ตาม
สำหรับการใช้ไลนิโซลิดร่วมกับยาปฏิชีวนะชนิดอื่นในการรักษาโณคที่เกิดจากการติดเชื้อแบคทีเรียนั้น มีการใช้ไลนิโซลิดร่วมกับยาอื่นในการรักษาวัณโรค อย่างไรก็ตาม ขนาดยาที่เหมาะสมของไลเนโวลิดในการรักษาภาวะดังกล่าวนั้นยังไม่มีการกำหนดให้เป็นที่แน่ชัด โดยทั่วไปแล้ว ในกรณีผู้ใหญ่ การใช้ยาดังกล่าวแบบให้วันละ 1 หรือ 2 ครั้งนั้นให้ผลการรักษาที่ดี แต่เนื่องจากการรักษาวัณโรคนั้นต้องใช้ระยะเวลานานหลายเดือน การเกิดอาการไม่พึงประสงค์จากการใช้ไลนิโซลิดถึงอาจเกิดได้ง่าย โดยเฉพาะเมื่อใช้ยาดังกล่าวในขนาดสูง อย่างไรก็ตาม ในปัจจุบันยังไม่มีหลักฐานเชิงประจักษ์ทางการแพทย์น่าเชื่อถือมากพอที่สนับสนุนถึงประสิทธิภาพและความปลอดภัยของการใช้ยานี้สำหรับข้อบ่งใช้ดังกล่าวเป็นประจำทุกวัน
นอกจากนี้ยังมีการใช้ไลนิโซลิดเป็นทางเลือกทดแทนแวนโคมัยซินในการรักษาภาวะไข้ที่มีภาวะเม็ดเลือดขาวนิวโตรฟิลต่ำ (febrile neutropenia) ในผู้ป่วยมะเร็งที่มีการติดเชื้อแบคทีเรียกรัมบวก ยิ่งไปกว่านั้น ไลนิโซลิดยังเป็นยาปฏิชีวนะอีกชนิดหนึ่งที่มาสารถแพร่ผ่านเข้าไปยังของเหลวภายในตาที่เรียกว่าวิเทรียสฮิวเมอร์ (vitreous humor) ได้ ซึ่งมียาปฏิชีวนะไม่กี่ชนิดเท่านั้นที่แพร่ผ่านเข้าไปบริเวณนั้นได้ ดังนั้น ไลนิโซลิดจึงอาจเป็นประโยชน์และมีประสิทธิภาพในการรักษาการติดเชื้อแบคทีเรียภายในลูกตา (Endophthalmitis) ที่มีสาเหตุมาจากเชื้อแบคทีเรียที่ไวต่อยานี้ได้ แต่มีหลักฐานเชิงประจักษ์จำนวนเพียงเล็กน้อยเท่านั้นที่ให้ผลสนับสนุนการใช้ยานี้สำหรับข้อบ่งใช้ดังกล่าว เนื่องจากการรักษาการติดเชื้อแบคทีเรียภายในลูกตาในปัจจุบันมีการใช้แวนโคมัยซินในการรักษากันอย่างแพร่หลายและให้ประสิทธิผลในการรักษาเป็นที่น่าพึงพอใจอยู่แล้ว
การติดเชื้อแบคทีเรียในระบบประสาทส่วนกลาง
การศึกษาในสัตว์ทดลองที่มีภาวะเยื่อหุ้มสมองอักเสบ (Meningitis) จากเชื้อแบคทีเรียเสตร็ปโทโคคัส นิวโมเนีย (Streptococcus pneumoniae) พบว่าไลนิโซลิดสามารถแทรกซึมเข้าไปยังน้ำหล่อเลี้ยงสมองและไขสันหลัง (cerebrospinal fluid) ได้ และมีประสิทธิมากกว่ายาปฏิชีวนะชนิดอื่นที่เข้าไปในบริเซณดังกล่าวได้ อย่างไรก็ตาม ยังไม่มีหลักฐานเชิงประจักษ์คุณภาพสูงที่สนับสนุนการใช้ไลนิโซลิดเป็นประจำในการรักษาภาวะการติดเชื้อดังกล่าว ถึงกระนั้น มีผู้ป่วยหลายรายที่ประสบผลสำเร็จในการรักษาการติดเชื้อแบคทีเรียในระบบประสาทส่วนกลาง ซึ่งรวมไปถึง ภาวะเยื้อหุ้มสมองงอักเสบ ด้วยไลนิโซลิด ดังนั้น จึงอาจพอสรุปได้ว่าการใช้ไลนิโซลิดในการรักษาภาวะดังกล่าวนั้นเป็นทางเลือกที่สมเหตุสมผลเมื่อการรักษาหรือยาปฏิชีวนะอื่นไม่ได้ผลการรักษาเป็นที่น่าพึงพอใจ แนวทางการรักษาของสมาคมโรคติดเชื้อแห่งสหรัฐอเมริกา (Infectious Diseases Society of America) ได้แนะนำให้ไลนิโซลิดเป็นการรักษาทางเลือกแรกของภาวะเยื่อหุ้มสมองอักเสบที่มีสาเหตุมาจากเชื้อแบคทีเรียกลุ่มแอนเทอโรคอคคัสที่ดื้อต่อยาแวนโคมัยซิน (Vancomycin Resistant Enterococcus; VRE) และเป็นทางเลือกรองต่อจากแวนโคมัยซินในการรักษาภาวะเยื่อหุ้มสมองอักเสบที่มีสาเหตุมาจากเชื้อแบคทีเรียสแตปฟิโลคอคคัส ออเรียสที่ดื้อยาต่อยาเมทิซิลลิน (methicillin-resistant Staphylococcus aureus ;MRSA) นอกจากนี้ยังพบว่าไลนิโซลิดมีประสิทธิภาพเหนือกว่าแวนโคมัยซินในการรักษาภาวะเยื่อหุ้มสมองอักเสบที่มีสาเหตุมากจากการติดเชื้อแบคทีเรียสแตปฟิโลคอคคัส ออเรียสที่ดื้อยาต่อยาเมทิซิลลิน จากนอกโรงพยาบาล (community-acquired MRSA) อย่างไรก็ตาม การตีพิมพ์ในวารสารที่เกี่ยวกับผู้ป่วยภาวะดังกล่าวที่ได้รับการรักษาด้วยไลนิโซลิดนั้นยังมีอยู่น้อยมาก (ข้อมูลเมื่อ 2009).
การติดเชื้อแบคทีเรียที่สัมพันธ์กับการใส่สายสวน
ในเดือนมีนาคม ค.ศ. 2007 องค์การอาหารและยาของสหรัฐอเมริการะบุว่าได้มีการศึกษาแบบสุ่มและมีกลุ่มควบคุมและเป็นแบบเปิด ขั้นที่ 3 ซึ่งทำการศึกษาในอาสาสมัคร (phase III clinical trial) เพื่อเปรียบเทียบประสิทธิภาพของไลนิโซลิดกับแวนโคมัยซินในการรักษาการติดเชื้อแบคทีเรียในกระแสเลือดที่มีความสัมพันธ์กับการใส่สายสวน (catheter-related bloodstream infections) ซึ่งผู้ป่วยที่ได้รับการรักษาด้วยแวนโคมัยซินจะได้รับการรักษาเปลี่ยนเป็นออกซาซิลลิน หรือไดคลอกซาซิลลิน ถ้าพบว่าเชื้อสาเหตุนั้นไวต่อยาข้างต้น และผู้ปวยทั้งสองกลุ่ม (กลุ่มที่ได้รับการรักษาด้วยไลนิโซลิดและกลุ่มที่ได้รับการรักษาด้วยแวนโคมัยซิน) จะได้รับยาปฏิชีวนะสำหรับต้านเชื้อแบคทีเรียแกรมลบ หากมีข้อบ่งชี้ที่จำเป็น ต่อมาผลการศึกษาดังกล่าวได้ถูกตีพิมพ์เผยแพร่ในเดือนมกราคม ค.ศ. 2009
จากผลการศึกษาในการศึกษาดังข้างต้นพบว่า การใช้ไลนิโซลิดมีอัตราการเสียชีวิตมากกว่าการใช้แวนโคมัยซินอย่างมีนัยสำคัญทางสถิติ โดยเมื่อทำการรวบรมข้อมูลทั้งหมดแล้วพบว่า ร้อยละ 21.5 ของผู้ป่วยที่ได้รับการรักษาด้วยไลนิโซลิดเสียชีวิต ขณะที่อีกหลุ่มหนึ่งที่ไม่ได้รับการรักษาด้วยไลนิโซลิดเสียชีวิตเพียงร้อยละ 16 โดยความแตกต่างของอัตราการเสียชีวิตนี้เป็นผลมาจากเชื้อสาเหตุที่ต่างกลุ่มกัน โดยเมื่อจำแนกกลุ่มผู้ป่วยออกเป็นกลุ่มที่มีเชื้อสาเหตุเป็นเชื้อแบคทีเรียแกรมบวกกับกลุ่มที่มีเชื้อสาเหตุเป็นทั้งแบคทีเรียแกรมบวกและแกรมลบ พบว่าในผู้ป่วยที่มีเชื้อสาเหตุเป็นเชื้อแบคทีเรียกรัมบวกอย่างเดียวนั้นพบว่าไลนิโซลิดมีประสิทธิภาพและความปลอดภัยเทียบเท่ากับแวนโคมัยซิน จากผลการศึกษาในครั้งนี้ทำให้องค์การอาหารและยาแห่งสหรัฐอเมริกาออกคำเตือนถึงบุคลากรทางการแพทย์ว่ายังไม่มีการรับรองให้ใช้ไลนิโซลิดในการรักษาโรคติดเชื้อที่สัมพันธ์กับการใส่สายสวนหรือโรคติดเชื้ออื่นใดที่มีสาเหตุมาจากเชื้อแบคทีเรียแกรมบวก และถึงแม้ว่าจะมีการตรวจพบเชื้อแบคทีเรียแกรมลบว่าเป็นเชื้อสาเหตุหรือสงสัยว่าอาจเป็นเชื้อสาเหตุก็ควรเลือกใช้ยาปฏิชีวนะชนิดอื่นที่เหมาะสมเป็นทางเลือกแรกก่อน
การใช้ยาในกลุ่มประชากรพิเศษ
การใช้ยาไลนิโซลิดในผู้ใหญ่และเด็กที่มีอายุมากกว่า 12 นั้นจะบริหารยาให้ทุกๆ 12 ชั่วโมง ทั้งในรูปแบบยารับประทานและยาชนิดฉีดเข้าหลอดเลือดดำ ส่วนในเด็กและทารกนั้น จะได้รับการบริหารยาให้ทุก 8 ชั่วโมง ส่วนในกลุ่มผู้สูงอายุ ผู้ป่วยที่มีภาวะตับวายระดับเล็กน้อยถึงปานกลาง และผู้ป่วยที่มีการทำงานของไตผิดปกติ ไม่จำเป็นต้องมีการปรับเปลี่ยนขนาดและความถี่ในการบริหารยา สำหรับผู้ป่วยที่ต้องมีการชำระเลือดผ่านเยื่อ (hemodialysis) ควรมีการบริหารยาไลนิโซลิดให้อย่างระมัดระวังหลังการทำหัตถการดังกล่าว เนื่องจากการชำระเลือดผ่านเยื่อจะทำให้ยาไลนิโซลิดในร่างกายถูกกำจัดออกไปประมาณร้อยละ 30 – 40 ส่วนผู้ป่วยที่ทำการฟอกเลือดด้วยเครื่องไตเทียม (hemofiltration) นั้นไม่จำเป็นต้องได้รับการบริหารยาดังกล่าวให้เพิ่มเติมภายหลัง ทั้งนี้ ผู้ป่วยบางกลุ่มอาจจำเป็นต้องได้รับการบริหารยาไลนิโซลิดถี่ขึ้น เช่นในการศึกษาหนึ่งซึ่งพบว่า ผู้ป่วยที่มีแผลไหม้มากกว่าร้อยละ 20 ของพื้นที่ผิวร่างกายทั้งหมดอาจจำเป็นต้องได้รับการบริหารยาไลนิโซลิดที่ถี่กว่าปกติเนื่องจากมีการขับยาดังกล่าวออกช่องทางอื่นที่ไม่ใช่ทางไต (nonrenal clearance) เพิ่มมากขึ้น
สำหรับหญิงตั้งครรภ์นั้น ดัชนีความปลอดภัยการใช้ยาไลนิโซลิดในหญิงตั้งครรภ์ถูกจัดให้อยู่ในระดับ C เนื่องจากยังไม่มีการศึกษามากพอถึงความปลอดภัยของการใช้ยาดังงกล่าวในหญิงตั้งครรภ์ ถึงแม้จะมีการศึกษาหลายการศึกษาในสัตว์ทดลองที่ตั้งครรภ์แล้วพบว่าเกิดความเป็นพิษต่อตัวอ่อนในครรภ์ในระดับต่ำ และประโยชน์ที่ได้จากยาดังกล่าวจะมากกว่าอันตรายที่อาจเกิดก็ตาม นอกจากนี้ ไลนิโซลิดยังสามารถถูกกำจัดออกทางน้ำนมได้ ส่วนระดับความมีนัยสำคัญทางคลินิกนั้นยังไม่มีข้อมูลแน่ชัด
ขอบข่ายการออกฤทธิ์
ในทางคลินิก ไลนิโซลิดมีฤทธิ์ต่อเชื้อแบคทีเรียแกรมบวกทุกชนิด ซึ่งเชื้อแบคทีเรียกลุ่มดังกล่าวจะมีผนังเซลล์ที่ประกอบไปด้วยชั้นเปปติโดกลัยแคนหนา และไม่มีเยื่อเลือกผ่านชั้นนอก เช่น เอ็นเทอโรค็อคคัส ฟีเชียม (Enterococcus faecium) และ เอนเทอโรคอคคัส ฟีคาลิส (Enterococcus faecalis – รวมไปถึงสกุลเอนเทอโรคอคคัสที่ดื้อต่อยาแวนโคมัยซิน; VRE), สแตปฟิโลคอคคัส ออเรียส (Staphylococcus aureus – รวมถึงสแตปฟิโลคอคคัส ออเรียสที่ดื้อต่อยาเมธิซิลลิน; MRSA), สเตรปโตคอกคัส อะกาแลกเตีย (Streptococcus agalactiae), สเตรปโตค็อกคัส นิวโมเนียอี (Streptococcus pneumoniae), สเตรปโตค็อกคัส ไพโอจีนัส (Streptococcus pyogenes), กลุ่มไวริแดนส์ของสเตร็ปโตคอกไค (viridans group streptococci) , ลิสทิเรีย โมโนไซโตจิเนส (Listeria monocytogenes) และสกุลสกุลโครีนีแบคทีเรียม (Corynebacterium) (โดยเชื้อมีความไวต่อยาไลนีโซลิดโดยมีค่าความเข้มข้นที่ต่ำที่สุดที่มีฤทธิ์ยับยั้งเชื้อโดยให้เป็นปกติที่ต่ำกว่า 0.5 mg/L) ไลนิโซลิดมีฤทธิ์อย่างมากต่อเชื้อสกุลไมโคแบคทีเรียม (Mycobacterium) ในการทดลองนอกกายมนุษย์ (in vitro) และมีประสิทธิภาพอย่างมากต่อเชื้อสกุลโนคาร์เดีย (Nocardia) แต่มีราคาที่สูงและมีเหตุการณ์ไม่พึงประสงค์เกิดขึ้นได้มาก จึงควรใช้ไลนิโซลิดร่วมกับยาปฏิชีวนะขนานอื่นๆ หรือใช้ในเฉพาะผู้ป่วยที่ล้มเหลวจากการักษาด้วยยาแบบดั้งเดิม
ทั้งนี้ ไลนิโซลิดเป็ยาปฏิชีวนะที่มีฤทธิ์ยับยั้งการสืบพันธุ์หรือการเติบโตต่อแบคทีเรียเป็นส่วนใหญ่ โดยไม่ได้ออกฤทธิ์ฆ่าเชื้อแบคทีเรียโดยตรง (bacteristatic antibiotic) อย่างไรก็ตาม ยาดังกล่าวจะมีฤทธิ์ในการฆ่าเชื้อแบคทีเรียโดยตรง (bactericidal) ต่อเชื้อแบคทีเรียสกุลสเตรปโตคอกคัส การศึกษาบางการศึกษาพบว่า แม้ว่าไลนีโซลิดจะมีฤทธิ์ยับยั้งการเติบโตและการสิบพันธุ์ในการทดลองนอกกายมนุษย์นั้น (in vitro) แต่ไลนีโซลิดกลับมีพฤติกรรมในการฆ่าเชื้อแบคทีเรียโดยตรงในการทดลองในกายมนุษย์ (in vivo) ด้วยการยับยั้งการผลิตสารพิษบางชนิดของเชื้อแบคทีเรียสกุลสแตฟฟิโลคอคคัส และสกุลสเตรปโตคอกคัส (streptococcus) นอกจากนี้ ไลนิโซลิดยังมีผลหลังการใช้ยาปฏิชีวนะ (post-antibiotic effect) 1 – 4 ชั่วโมงในแบคทีเรียส่วนใหญ่ ซึ่งหมายความว่าการเติบโตของแบคทีเรียได้รับการกดไว้ชั่วคราวแม้จะหยุดใช้ยาดังกล่าวแล้วก็ตาม
เชื้อแบคทีเรียแกรมลบ
ส่วนใหญ่แล้วไลนิโซลิดไม่มีผลทางคลินิกต่อแบคทีเรียแกรมลบ เช่น เชื้อแบคทีเรียสกุลสกุลซูโดโมแนส (Pseudomonas) และวงศ์เอนเทอร์โรแบคทีเรียซีอี (Enterobacteriaceae) แต่ในการทดลองนอกร่างกายมนุษย์ (In vitro) พบว่าไลนิโซลิดมีฤทธิ์ยับยั้งการเจริญเติบโตของเชื้อแบคทีเรียพาสเจอเรลลา มัลโตซิดา (Pasteurella multocida), สกุลฟูโซแบคทีเรียม (Fusobacterium), มอแรกเซลลา คาทาร์ราลิส (Moraxella catarrhalis), สกุลลีจิโอเนลลา (Legionella), สกุลบอร์เดเทลลา (Bordetella), และ เอลิซาเบธคิงเจีย เมนิงโกเซฟติกา (Elizabethkingia meningoseptica) ได้ดี และมีฤทธิ์ยับยั้งเชื้อฮีโมฟิลัส อินฟลูเอ็นซาอี (Haemophilus influenzae) ได้ค่อนข้างดี (มีความเข้มข้นของยาในระดับต่ำสุดที่สามารถยับยั้งการเจริญเติบโตของเชื้อแบคทีเรียได้ร้อยละ 90 ประมาณ 8 มิลลิกรัม/ลิตร) นอกจากนี้ยังมีการใช้ไลนิโซลิดเป็นทางเลือกรองในการรักษาโรคที่เกิดจากการติดเชื้อแบคทีเรียสกุลแคพโนไซโตฟากา (Capnocytophaga) อีกด้วย
การเปรียบเทียบกับยาปฏิชีวนะอื่น
ขอตเขตการออกฤทธิ์ต่อเชื้อแบคทีเรียแกรมบวกของไลนิโซลิดนั้นมีความคล้ายคลึงกันกับยาปฏิชีวนะกลุ่มไกลโคเปปไทด์ เช่น แวนโคมัยซิน ซึ่งถูกใช้เป็นมาตรฐานสำหรับรักษาโรคติดเชื้อแบคทีเรียสแตปฟิโลคอคคัส ออเรียสที่ดื้อยาต่อยาเมทิซิลลิน มาอย่างยาวนาน และยาปฏิชีวนะทั้งสองชนิดนี้มักถูกนำมาเปรียบเทียบกันบ่อยครั้งทั้งในการศึกษาทดลองและการใช้จริงทางคลินิก ยาอื่นที่มีการนำมาเปรียบเทียบประสิทธิภาพกับไลนิโซลิด ได้แก่ ไทโคพลานิน (ชื่อการค้า Targocid, เป็นยากลุ่มไกลโคเปปไทด์เช่นเดียวกันกับแวนโคมัยซิน), ควินูปริสติน/ดาลโฟปริสติน (quinupristin/dalfopristin – ชื่อการค้า คือ Synercid เป็นยาสูตรผสมของยาปฏิชีวนะสองชนิดในกลุ่มสเตรปโตกรามิน แต่ไม่มีฤทธิ์ต่อเชื้อ E. faecalis), และเดปโตมัยซิน (daptomycin – ชื่อการค้าคือ Cubicin เป็นยาปฏิชีวนะในกลุ่มไลโปเปปไทด์), และยาปฏิชีวนะอื่นอีกหลายชนิดที่กำลังอยู่ในขั้นตอนการศึกษาวิจัย เช่น เซฟโตบิโพรล (ceftobiprole), ดาลบาวานซิน (dalbavancin), และเทลาวานซิน (telavancin) โดยในยาที่กล่าวมาข้างต้นทั้งหมดนี้ มีเพียงไลนิโซลิดเพียงชนิดเดียวเท่านั้นที่สามารถบริหารยาโดยการรับประทานได้ นอกเหนือจากไลนิโซลิดแล้ว ในอนาคต โอริวานซิน (oritavancin) และอิคลาปริม (iclaprim) ซึ่งกำลังอยู่ในขั้นตอนแรกของการศึกษาพัฒนาทางคลินิก อาจเป็นอีกทางเลือกหนึ่งที่สามารถบริหารยาโดยการรับประทานได้
อาการไม่พึงประสงค์
การใช้ไลนิโซลิดในระยะสั้นๆมีความปลอดภัยค่อนข้างสูงอาการไม่พึงประสงค์ที่พบได้ทั่วไป (พบมากกว่าร้อยละ 1 ของผู้ป่วยที่ได้รับไลนิโซลิด) จากการใช้ยาดังกล่าว ได้แก่ ท้องเสีย (มีรายงานการเกิดร้อยละ 3–11% ในอาสาสมัครที่เข้าร่วมการศึกษาทางคลินิก), ปวดศีรษะ (1–11%), คลื่นไส้ (3–10%), อาเจียน (1–4%), ผื่น (2%), ท้องผูก (2%), การรับรู้รสชาติผิดแปลกไป (1–2%), และ ลิ้นมีสีผิดปกติ (0.2–1%). นอกจากนี้ การติดเชื้อรา ได้แก่ การติดเชื้อราแคนดิดาในช่องปาก (Oral candidiasis) และการติดเชื้อราในช่องคลอด (candidal vulvovaginitis) อาจพบได้ในกรณีที่ไลนิโซลิดกดการเจิรญเติบโตของจุลินทรีย์ประจาถิ่น (normal bacterial flora) ในบริเวณดังกล่าวไว้ ซึ่งเป็นช่องทางที่ทำให้เกิดการติดเชื้อราตามมาในภายหลังได้ง่าย ส่วนอาการไม่พึงประสงค์อื่นๆที่พบได้น้อย แต่มักมีความรุนแรงมาก ได้แก่ ปฏิกิริยาการแพ้ยา, ตับอ่อนอักเสบ, และการเพิ่มขึ้นของเอนไซม์ทรานซามิเนส (transaminases), ซึ่งอาจเป็นสัญญาณที่บ่งบอกถึงการเกิดความเสียหายของตับ ไลนิโซลิดมีความแตกต่างจากยาปฏิชีวนะชนิดอื่น เช่น อิริโทรมัยซิน และกลุ่มควิโนโลน, ตรงที่ไม่ส่งผลให้เกิดการเปลี่ยนแปลงของระยะ QT จากการบันทึกคลื่นไฟฟ้าหัวใจ ทั้งนี้ อาการไม่พึงประสงค์จากการใช้ไลนิโซลิดที่พบในเด็กนั้นไม่มีความแตกต่างจากที่พบในผู้ใหญ่
เช่นเดียวกับยาปฏิชีวนะชนิดอื่น การใช้ไลนิโซลิดมีความสัมพันธ์กับการเกิดภาวะอักเสบของลำไส้ใหญ่ที่เกิดจากเชื้อแบคทีเรียครอสตริเดียม ดิฟฟีซิเล (Clostridium difficile colitis หรือ Clostridium difficile-associated diarrhea; CDAD) ถึงแม้จะพบการเกิดความผิดปกติดังกล่าวจากการศึกษาทางคลินิกได้น้อยเพียง 1 ใน 2000 คน แต่จากการทดลองนอกร่างกายมนุษย์ (in vitro) ดูเหมือนว่า C. difficile จะไวต่อไลนิโซลิด ดังนั้น ไลนิโซลิดจึงอาจเป็นทางเลือกที่เป็นไปได้สำหรับการรักษาภาวะ CDAD.
การใช้ยาในระยะยาว
การถูกกดการทำงานของไขกระดูก (Bone marrow suppression) โดยเฉพาะการเกิดภาวะเกล็ดเลือดต่ำ (Thrombocytopenia) อาจพบได้ในผู้ป่วยที่ได้รับการรักษาด้วยไลนิโซลิด ซึ่งเป็นอาการไม่พึงประสงค์ที่เกิดจากการกดการทำงานของไขกระดูกเพียงชนิดเดียวที่พบการเกิดในผู้ที่ได้รับยาไลนิโซลิดมากกว่าผู้ที่ได้รับยาปฏิชีวนะกลุ่มอะมิโนไกลโคไซด์ และกลุ่มเบตาแลคแตม อย่างมีนัยสำคัญทางสถิติ โดยทั่วไปแล้วมักไม่พบการเกิดอาการไม่พึงประสงค์ดังกล่าวในผู้ป่วยที่ได้รับยาไม่มากเกินกว่า 14 วัน แต่จะพบการเกิดความผิดปกติดังกล่าวได้มากในผู้ป่วยที่ได้รับยาต่อเนื่องเป็นระยะเวลานานหรือผู้ป่วยที่มีการทำงานของไตลดลง มีกรณีศึกษาที่ได้รับการบันทึกไว้ในปี ค.ศ. 2004 พบว่า ไพริดอกซีน (รูปแบบหนึ่งของวิตามินบี 6) สามารถช่วยป้องกันการเกิดภาวะโลหิตจางและภาวะเกล็ดเลือดต่ำที่เกิดจากการใช้ยาไลนิโซลิดได้ ต่อมาในปี ค.ศ. 2006 การศึกษาวิจัยทางคลินิกขนาดใหญ่อีกการศึกษาหนึ่งกลับพบว่า การได้รับไพริดอกซีนนั้น ไม่มีผลป้องกันการเกิดความผิดปกติดังกล่าวแต่อย่างใด
นอกจากนี้ การใช้ไลนิโซลิดในระยะยาวยังมีความสัมพันธ์กับการเกิดเหตุพยาธิสภาพประสาทส่วนปลายเนื่องจากเคมีบำบัด (en) ซึ่งเป็นความผิดปกติที่เกิดขึ้นอย่างถาวร ผู้ป่วยจะมีอาการชาคล้ายเข็มทิ่ม (tingling numbness), ปวดเจ็บแปลบ (sharp pain), มีความไวต่อความเย็นมากขึ้น โดยอาการจะเริ่มจากบริเวณมือและเท้า ในบางครั้งอาจมีการกระจายไปยังบริเวณแขนแและขาได้ยาเคมีบำบัด (en) ที่มีความสัมพันธ์กับการเกิดความผิดปกติดังกล่าว เช่น ธาลิโดไมด์ (en), ยากลุ่มอีโปธีโลน (en) ได้แก่ ไอซาบีพีโลน (en), ยากลุ่มวินคาแอลคาลอยด์ (en) ได้แก่ วินคริสทีน (en) และวินบลาสทิน (en),ยากลุ่มแทกเซน ได้แก่ แพคลิแทกเซล (en) และโดซีแทกเซล (en), ยากลุ่มโปรตีโซมอินฮิบิเตอร์ (en) ได้แก่ บอร์ทีโซมิบ (en), และยากลุ่มแพลทินัมเบส ได้แก่ ซิสพลาติน, ออกซาลิพลาติน (en) และคาร์โบพลาติน (en). อีกทั้งการเกิดพยาธิสภาพที่ประสาทตา (en) ก็มีความสัมพันธ์กับการใช้ยาไลนิโซลิดเช่นกัน โดยมักเกิดขึ้นได้ง่ายหลังจากการใช้ยาดังกล่าวต่อเนื่องเป็นระยะเวลานานหลายเดือน และอาจกลายเป็นความผิดปกติแบบถาวรได้ในบางราย ถึงแม้ว่ากลไกในการทำให้เกิดความผิดปกติดังข้างต้นนั้นจะไม่สามารถเข้าใจได้อย่างแน่ชัด แต่คาดว่าการได้รับความเสียหายของไมโทคอนเดรีย (Mitochondrial toxicity) น่าจะเป็นสาเหตุของความผิดปกติดังกล่าว ทั้งนี้เนื่องจากไมโทคอนเดรียนั้นมีโครงสร้างที่คล้ายคลึงกันกับไรโบโซมของแบคทีเรียซึ่งเป็นเป้าหมายการออกฤทธิ์ของไลนิโซลิด การเกิดภาวะเลือดเป็นกรดแล็กติกจากการได้รับยาไลนิโซลิดก็เป็นอาการไม่พึงประสงค์อีกอย่างหนึ่งที่รุนแรงจนอาจก่อให้เกิดอันตรายต่อชีวิต โดยเกิดขึ้นได้จากการเพิ่มขึ้นของกรดแล็กติกในร่างกาย ซึ่งอาจพบได้พร้อมกันกับการเกิดพิษต่อไมโทคอนเดรียที่กล่าวมาดังข้างต้น เนื่องมาจากการเกิดอาการไม่พึงประสงค์จากการใช้ไลนิโซลิดต่อเนื่องเป็นระยะเวลานานดังข้างต้น ผู้ป่วยกลุ่มดังกล่าวจึงต้องได้รับการตรวจความสมบูรณ์ของเม็ดเลือดแดงเป็นประจำทุกสัปดาห์ระหว่างที่ยังได้รับยาดังกล่าวอยู่ ทั้งนี้เพื่อเป็นการติตามความเป็นไปได้ที่อาจจะเกิดการกดการทำงานของไขกระดูก และไม่ควรใช้ยาไลนิโซลิดต่อเนื่องนานเกิน 28 วัน เพื่อหลีกเลี่ยงการเกิดอาการไม่พึงประสงค์ที่รุนแรงจากยา นอกจากนี้ ในปี ค.ศ. 2006 ได้มีการคิดค้นพัฒนามาตรการในการติดตามและเฝ้าระวังการเกิดอาการไม่พึงประสงค์ที่รุนแรงในผู้ป่วยหนักที่ได้รับการรักษาด้วยไลนิโซลิดโดยทีมนักวิจัยในเมืองเมลเบิร์น ประเทศออสเตรเลีย ทั้งนี้เพื่อให้สามารถคาดคะเนความน่าจะเป็นที่จะเกิดอาการไม่พึงประสงค์ที่รุนแรงในผู้ป่วยกลุ่มดังกล่าวได้แม่นยำมากขึ้น โดยมาตราการดังกล่าวได้แก่ การตรวจความสมบูรณ์ของเม็ดเลือดแดง, การตรวจการทำงานของตับ และการวัดค่าระดับกรดแล็กติกในกระแสเลือดเป็นจำนวน 2 ครั้งต่อสัปดาห์; การทบทวนรายการยาอื่นที่ผู้ป่วยได้รับขณะรักษา โดยหากพบรายการใดที่อาจเกิดอันตรกิริยาระหว่างยากับไลนิโซลิดอาจพิจารณาปรับเปลี่ยนแบบแผนการรักษาสำหรับรายการนั้นๆ; และการตรวจตาและระบบประสาทเป็นระยะในผู้ป่วยที่ได้รับการรักษาด้วยไลนิโซลิดต่อเนื่องเกินกว่า 4 สัปดาห์
การเกิดอาการไม่พึงประสงค์จากการได้รับการรักษาด้วยไลนิโซลิดต่อเนื่องเป็นระยะเวลานานถูกพบเป็นครั้งแรกในการเก็บข้อมูลการรักษา ความปลอดภัยและประสิทธิผลของยาหลังออกสู่ตลาด (postmarketing surveillance) โดยการเกิดการกดการทำงานของไขกระดูกนั้นไม่พบการเกิดในการทดลองขั้นที่ 3 ซึ่งมีการใช้ยาดังกล่าวไม่มากเกินกว่า 21 วัน อย่างไรก็ตาม อาสาสมัครบางคนในช่วงแรกของการทดลองทางคลินิกนั้นเกิดภาวะเกล็ดเลือดต่ำ แต่สามารถกลับมาเป็นปกติได้ในภายหลังและไม่พบความแตกต่างจนถึงระดับที่มีนัยสำคัญเมื่อเปรียบเทียบกับกลุ่มควบคุมซึ่งไม่ได้รับการรักษาด้วยไลนิโซลิด นอกจากนี้ยังมีรายงานการเกิดลมชัก,ภาวะอัมพาตแบบเบลล์ (ความผิดปกติของเส้นประสาทเฟเชียล) จำนวน 1 ราย ข้อมูลเมื่อ 2009 และการเกิดพิษต่อไต (en) ในการเก็บข้อมูลการรักษา ความปลอดภัยและประสิทธิผลของยาหลังออกสู่ตลาดของไลนิโซลิด
อันตรกิริยา
ไลนิโซลิดออกฤทธิ์เป็นตัวยับยั้งเอนไซม์มอนอเอมีนออกซิเดส (monoamine oxidase inhibitor; MAOI) อย่างอ่อนๆ ดังนั้นจึงไม่ควรใช้ยานี้ร่วมกับยาในกลุ่ม MAOIs ชนิดอื่นๆ รวมไปถึงอาหารที่มีปริมาณของไทรามีน (en) สูง (เช่น เนื้อหมู, เนยแข็งที่มีอายุมาก, เครื่องดื่มแอลกอฮอล์, อาหารดองหรือรมควัน), ยาที่มีผลเพิ่มระดับเซโรโทนิน เนื่องจากการเก็บข้อมูลการรักษา ความปลอดภัยและประสิทธิผลของยาหลังออกสู่ตลาด (postmarketing surveillance) ของไลนิโซลิด พบการเกิดกลุ่มอาการเซโรโทนิน เมื่อมีใช้ยาร่วมกับยาอื่นยาที่มีผลเพิ่มระดับเซโรโทนิน หรือใช้ยาไลนิโซลิดทันทีหลังจากหยุดยากลุ่มดังกล่าว โดยเฉพาะอย่างยิ่งยากลุ่มที่ทำหน้าที่ยับยั้งการเก็บกลับเซโรโทนิน เช่น พาร็อกซีทีน (en) และเซอร์ทราลีน (en) นอกจากนี้ ไลนิโซลิดยังมีเสริมผลของการเพิ่มระดับความดันโลหิตของยาที่ออกฤทธิ์กระตุ้นระบบประสาทซิมพาเทติก (en) เช่น ซูโดอีเฟดรีน หรือเฟนิลโพรพาโนลามีน (en) นอกจากนี้ ยาระงับอาการปวดอย่างเพทิดีน ก็เป็นยาอีกชนิดหนึ่งที่ไม่ควรใช้ร่วมกันกับไลนิโซลิดไม่ว่าในกรณีใดๆก็ตาม เนื่องจากความเสี่ยงที่อาจทำให้เกิดกลุ่มอาการเซโรโทนิน
ไลนิโซลิดไม่มีผลยับยั้งหรือเหนี่ยวนำการทำงานของระบบเอนไซม์ไซโทโครม P450 (CYP 450; en) ซึ่งเป็นระบบเอนไซม์ของร่างกายที่ทำหน้าที่ในการขับยาออกจากร่างกาย ดังนั้นไลนิโซลิดจึงไม่เกิดอันตรกิริยาระหว่างยากับยาอื่นที่ต้องมีการเมแทบอลิซึมโดยระบบเอนไซม์นี้
เภสัชวิทยา
เภสัชจลนศาสตร์
ไลนิโซลิดเป็นยาที่มีชีวปริมาณออกฤทธิ์สูงเกือบร้อยละ 100 เมื่อบริหารยาโดยการรับประทาน ซึ่งหมายความว่าปริมาณยาทั้งหมดที่รับประทานเข้าไปสามารถเข้าสู่กระแสเลือดได้เกือบทั้งหมด ซึ่งแทบไม่มีความแตกต่างกันกับการบริหารยาโดยการฉีดเข้าหลอดเลือดดำ แสดงว่าผู้ป่วยที่ได้รับยาโดยการฉีดเข้าหลอดเลือดดำอาจสามารถเปลี่ยนมาใช้ยาในรูปแบบรับประทานได้เลยหากผู้ป่วยทีสภาวะที่เหมาะสมกับการใช้ยาในรูปแบบรับประทาน ในขณะที่ยาปฏิชีวนะชนิดอื่นที่มีข้อบ่งใช้และประสิทธิภาพใกล้เคียงกับไลนิโซลิดอย่างแวนโคมัยซินและควินูปริสติน/ดาลโฟปริสตินนั้นสามารถบริหารยาได้เพียงการฉีดเข้าหลอดเลือดดำเท่านั้น การรับประทานไลนิโซลิดร่วมกับอาหารอาจส่งผลให้ตัวยาถูกดูดซึมได้ช้าลง แต่ขนาดยาที่ถูกดูดซึมเข้าสู่กระแสเลือดทั้งหมดที่วัดจากพื้นที่ใต้เส้นโค้ง (area under curve; AUC) นั้นไม่มีความแตกต่างกันกับการรับประทานยาในขณะท้องว่าง
ไลนิโซลิดมีสัดส่วนการจับกับโปรตีนในกระแสเลือด (plasma protein binding) ค่อนข้างต่ำ (ประมาณร้อยละ 31 แต่ค่าที่วัดได้ในแต่ละครั้งมีความผันผวนสูง) และมีปริมาตรกระจายตัว (volume of distribution) ที่สภาวะคงตัว (steady state) ประมาณ 40–50 ลิตร. สามารถตรวจวัดความเข้มข้นของยาในเลือดสูงสุด (Peak serum concentrations; Cmax) ได้ที่ประมาณ 1 - 2 ชั่วโมงหลังจากบริหารยา ไลนิโซลิดสามารถกระจายตัวไปยังเนื้อเยื่อต่างๆของร่างกายได้อย่างรวดเร็ว ยกเว้น เนื้อพื้นของกระดูก (Bone matrix) และเนื้อเยื่อไขมันสีขาว (en) เป็นที่น่าสังเกตว่าความเข้มข้นของไลนิโซลิดในของเหลวภายในเซลล์เยื่อบุของทางเดินหายใจส่วนล่างนั้นอย่างน้อยที่สุดจะเทียบเท่ากับความเข้มข้นของยาดังกล่าวในกระแสเลือดเสมอ และพบว่าโดยส่วนใหญ่แล้วมักมีค่ามากกว่าความเข้มข้นในกระแสเลือดอีก (บางการศึกษาพบว่าความเข้มข้นของยานี้ในของเหลวภายในเซลล์ของหลอดลมนั้นมีค่าสูงกว่าความเข้มข้นในกระแสเลือดมากถึง 4 เท่า) ซึ่งอาจเป็นคำอธิบายได้ว่าเหตุใดไลนิโซลิดถึงมีประสิทธิภาพในการรักษาโรคปอดบวม อย่างไรก็ตาม เมื่อวัดความเข้มข้นของยานี้ในน้ำหล่อสมองไขสันหลัง พบว่ามีความเข้มข้นของยาสูงสุดที่วัดได้นั้นมีค่าน้อยกว่าความเข้มข้นที่วัดได้จากกระแสเลือด ทั้งนี้อาจเป็นผลมาจากการที่ยาสามารถผ่านตัวกรองกั้นระหว่างเลือดและสมอง (en) ได้ช้า ในทางตรงกันข้าม ความเข้มข้นต่ำสุดของยานี้ในน้ำหล่อสมองไขสันหลังกลับมีค่ามากกว่าที่วัดได้จากในกระแสเลือด ทั้งนี้ก็เนื่องมาจากเหตุผลที่เกี่ยวข้องกับตัวกรองกั้นระหว่างเลือดและสมองเช่นกัน ส่วนค่าครึ่งชีวิตของไลนิโซลิดนั้นมีค่าประมาณ 3 ชั่วโมงในเด็ก, 4 ชั่วโมงในวัยรุ่น และ 5 ชั่วโมงในผู้ใหญ่
ในกระบวนการกำจัดไลนิโซลิดออกจากร่างกายนั้น ไลนิโซลิดจะถูกเมแทบอลิซึมที่ตับโดยการเกิดปฏิกิริยาออกซิเดชันของวงมอร์โฟลีน (en) โดยกระบวนการการเปลี่ยนแปลงนี้จะไม่มีส่วนเกี่ยวข้องกับระบบเอนไซม์ไซโทโครม P450 (CYP 450; en) กระบวนการเปลี่ยนแปลงไลนิโซลิดเพื่อขับออกจากร่างกายนี้จะเปลี่ยนไลนิโซลิดให้อยู่ในรูปสารเมตาบอไลท์ที่ไม่ออกฤทธิ์ 2 ชนิดหลัก (คิดเป็นร้อยละ 45 และ 10 ของยาที่ถูกขับออกทั้งหมดที่สภาวะคงตัว), สารเมตาบอไลท์รองอีก 1 ชนิด, และสารเมตาบอไลท์อื่นๆอีกหลายชนิดแต่มีสัดส่วนไม่ถึงร้อยละ 1 ของสารเมตาบอไลท์ทั้งหมด การกำจัดไลเนโวลิดออกจากร่างกายนั้นมีความแตกต่างกันออกไปขึ้นอยู่กับอายุและเพศ โดยในเด็กจะมีอัตราการกำจัดยาออกที่สูงที่สุด ส่งผลให้ยามีค่าครึ่งชีวิตที่สั้น ส่วนในเพศหญิงจะมีอัตราการกำจัดยาออกช้ากว่าเพศชายประมาณร้อยละ 20 นอกจากนี้ความเร็วในการกำจัดไลนิโซลิดออกจากร่างกายยังมีความสัมพันธ์ทางสถิติแบบแปนผันตรงอย่างยิ่งกับการกำจัดครีเอตินินของไต ซึ่งเป็นมาตรวัดการทำงานของไต โดยเรียกค่าที่วัดได้นี่ว่า ค่าการกำจัดครีเอตินิน (creatinine clearance; CLCR).
กลไกการออกฤทธิ์

ยากลุ่มออกซาโซลิโดนนั้นจัดเป็นยาที่ออกฤทธิ์ยับยั้งการสังเคราะห์โปรตีน ซึ่งจะส่งผลให้เกิดการยับยั้งการเจริญเติบโตและการขยายพันธุ์ของเชื้อแบคทีเรียโดยการรบกวนการแปรรหัสพันธุกรรม ของเอ็มอาร์เอ็นเอในไรโบโซม อย่างไรก็ตาม กลไกการออกฤทธิ์ทั้งหมดของยากลุ่มนี้ยังไม่สามารถทราบได้แน่ชัด ส่วนกลไกการออกฤทธิ์ของไลนิโซลิดซึ่งเป็นยาปฏิชีวนะอีกชนิดหนึ่งในกลุ่มออกซาโซลิโดนนั้นดูเหมือนว่าจะออกฤทธิ์ยับยั้งที่ขั้นตอนแรกของการสังเคราะห์โปรตีน ซึ่งก็คือ การขัดขวางการสร้างโปรตีนในขั้นเริ่มต้น (initiation) ซึ่งแตกต่างจากยาปฏิชีวนะกลุ่มที่ออกฤทธิ์ยับยั้งการสร้างโปรตีนชนิดอื่นที่มักยับยั้งที่ขั้นการต่อสาย (elongation) ของการสังเคราะห์โปรตีน
นอกจากนี้แล้ว ไลนิโซลิดยังสามารถออกฤทธิ์ยับยั้งการจับกันของหน่วยย่อย 30S และ 50S ของไรโบโซม, ทีอาร์เอ็นเอ, และเอ็มอาร์เอ็นเอได้อีกด้วย โดยไลนิโซลิดจะขเไปจับกับหน่วยย่อย 23S ของ หน่วยย่อย 50S ซึ่งเป็นตำแหน่งที่จำเป็นต่อการรออกฤทธิ์ของเอนไซม์เปปติดิลทรานสเฟอเรส (en) โดยตำแหน่งดังกล่าวนั้นจะอยู่ใกล้กันกับตำแหน่งเป้าหมายของคลอแรมเฟนิคอล, ลินโคมัยซิน, และยาปฏิชีวนะชนิดอื่นๆ เนื่องด้วยกลไกการออกฤทธิ์ที่เป็นเอกลักษณ์ฌฉพาะของไลนิโซลิดนี้ การดื้อยาข้ามชนิดกันระหว่างไลนิโซลิดกับยาปฏิชีวนะชนิดอื่นที่ออกฤทธิ์ยับยั้งการสร้างโปรตีนจึงพบได้น้อยมากหรือแทบจะไม่เกิดขึ้นเลย
ในปี ค.ศ. 2008 โครงสร้างผลึกของไลนิโซลิดที่จับอยู่กับ 50S ของไรโบโซม ของอาร์เคีย Haloarcula marismortui ถูกค้นพบโดยทีมนักวิทยาศาสตร์แห่งมหาวิทยาลัยเยล และถูกนำไปเก็บรักษาไว้ในธนาคารข้อมูลโปรตีน (en) ส่วนนักวิทยาศาสตร์อีกทีมหนึ่งซึ่งพยายามสร้างแม่แบบจำลองกลไกการออกฤทธิ์ของยากลุ่มออกซาโซลิโดน จากผลึกโครงสร้างของไลนิโซลิดที่จับอบู่กับ หน่วยย่อย 50S ของ Deinococcus radiodurans พบว่า ไลนิโซลิดนั้นจะเข้ากับตำแหน่ง A site ของ 50S รวมไปถึงการออกฤทธิ์เปลี่ยนแปลงรูปร่าง 3 มิติ (en) ซึ่งส่งผลขัดขวางการเข้าจับของทีอาร์เอ็นเอกับบริเวณดังกล่าว และส่งผลให้ทีอาร์เอ็นเอเอาแยกตัวออกจากไรโบโซมไปในที่สุด
เภสัชเคมี
ณ ค่า pH ปกติภายในเซลล์ ไลนิโซลิดจะอยู่สภาพที่ไม่มีประจุ ละลายน้ำได้ดีปานกลาง (ประมาณ 3 มิลลิกรัม/มิลลิลิตร) และมีสัมประสิทธิ์การกระจายตัว (logP) ประมาณ 0.55.
![สูตรโครงสร้างแบบก้างปลาของ N-{[(5S) -3-[3-fluoro-4- (morpholin-4-yl) phenyl]-2-oxo-1,3-oxazolidin-5-yl]methyl}acetamide, แสดงหมู่มอร์โฟลิโนและหมู่ฟลูออโรในสีส้ม, ส่วนสีน้ำเงินเป็นโครงสร้างหลักที่จำเป็นต่อการออกฤทธิ์. โดยอะตอมคาร์บอนทุกอะตอมในโครงสร้างหลักจะใส่หมายเลขกำกับไว้เพื่อกำหนดตำแหน่ง](http://upload.wikimedia.org/wikipedia/commons/thumb/e/ea/Linezolid_showing_oxazolidinone_pharmacophore.svg/250px-Linezolid_showing_oxazolidinone_pharmacophore.svg.png)
สารประกอบฟาร์มาโคฟอร์ออกซาโซลิไดโอนถือเป็นโครงสร้างหลักที่มีความจำเป็นต่อการออกฤทธิ์ต้านเชื้อแบคทีเรียของไลนิโซลิด โดยโครงสร้างของไลนิโซลิดนั้นจะประกอบไปด้วยส่วนของโมเลกุล 1,3-oxazolidin-2-one ที่ม่หมู่แอริล (aryl) ที่ตำแหน่งที่ 3 โดยมีหมู่ S-เมธิลแทนที่อะตอมคาร์บอนในตำแหน่งดังกล่าว ในตำแหน่งที่ 5 จะมีหมู่ฟังก์ชันอื่นมาเกาะอยู่ (R-enantiomer ของยากลุ่มออกซาโซลิไดโอนทั้งหมดนั้นไม่มีคุณสมบัติในการต้านเชื้อแบคทีเรีย) ทั้งนี้ จากโครงสร้างดังข้างต้น เนื่องจากไลนิโซลิดนั้นมีหมู่ฟังก์ชันหลายชนิดที่ถูกออกแบบมาเพื่อช่วยเพิ่มประสิทธิภาพและความปลอดภัยในการใช้ยา โดยหมู่อะเซตาไมด์ (en) ตรงตำแหน่งหมู่ 5-methyl เป็นตำแหน่งที่ดีที่สุดที่ช่วยในการเพิ่มประสิทธิภาพในการต้านเชื้อแบคทีเรียของยานี้ และยังคงถูกใช้ในการพัฒนายากลุ่มออกซาโซลิไดโอนชนิดอื่นๆต่อเนื่องมาจนถึงปัจจุบัน การเปลี่ยนแปลงตำแหน่งหมู่อะเซตาไมด์ออกไปจากตำแหน่งนี้จะทำให้ยาสูญเสียความสามารถในการต้านเชื้อแบคทีเรียลง แต่ก็ยังสามารถออกฤทธิ์ได้เล็กน้อยถึงปานกลางเนื่องจากยังมีคุณสมบัติเป็น Bioisosteres ส่วนอะตอมฟลูออรีน ณ ตำแหน่งที่ 3′ สามารถเพิ่มประสิทธิภาพในการต้านเชื้อแบคทีเรียของยาได้เป็น 2 เท่าทั้งการทดลองในมนุษย์ (in vivo) และนอกร่างกายมนุษย์ (in vitro) นอกจากนี้ ตัวให้อิเล็กตรอน (en) อย่างอะตอมไนโตรเจนในวงมอร์โฟลีนจะช่วยคงสภาพความแรง (potency) ของตัวยา รวมไปถึงความปลอดภัยจากการใช้ยานี้ด้วย
ทั้งนี้ พบว่ายาต้านการแข็งตัวของเลือดอย่าง ไรวาร็อกซาแบน (Rivaroxaban; ชื่อการค้าคือ Xarelto) นั้นมีโครงสร้างที่คล้ายคลึงกันกับไลนิโซลิดจนน่าแปลกใจ โดยยาทั้งสองชนิดมีโครงสร้างส่วนสารประกอบฟาร์มาโคฟอร์ออกซาโซลิไดโอนที่เหมือนกัน โดยบนโครงสร้างมีความแตกต่างกันเพียง 3 ตำแหน่ง คือ ไรวาร็อกซาแบนจะมีหมู่คีโตนและหมู่คลอโรไธโอฟีน (chlorothiophene) เพิ่มเข้ามา และไม่มีอะตอมของฟลูออรีนที่ตำแหน่ง 3′ อย่างไรก็ตาม ความคล้ายคลึงกันทางโครงสร้างของยาทั้งสองชนิดนี้ไม่มีผลจนมีนัยสำคัญทางคลินิกแต่อย่างใด
การสังเคราะห์
ในปัจจุบัน ไลเนโวลิดนั้นจะมาจากการสังเคราะห์ทั้งหมด เนื่องจากไม่สามารถพบสารประกอบนี้ได้ในธรรมชาติ (ซึ่งต่างจากยาปฏิชีวนะชนิดอื่นๆ) และไม่ได้ถูกพัฒนามาจากโครงสร้างของสารประกอบฟาร์มาโคฟอร์ที่ได้มาจากธรรมชาติ (ซึ่งมักพบในการสังเคราะห์ยาปฏิชีวนะกลุ่มเบตาแลคแตม ซึ่งเป็นยากึ่งสังเคราะห์) โดยการสังเคราะห์ออกซาโซลิไดโอนนั้นสามารถทำได้หลากหลายวิธี และช่องทองการสังเคราะห์ไลนิโซลิดนั้นก็มีความหลากหลายมากเช่นเดียวกัน ถึงแม้การผลิตไลนิโซลิดออกจำหน่ายในตลาดจะได้รับผลตอบแทนค่อนข้างสูง แต่กระบวนการผลิตแบบดั้งเดิม (ซึ่งถูกพัฒนาขึ้นโดยบริษัทอัพจอห์น (Upjohn) เพื่อทดลองผลิตไลนิโซลิดและอีพีเรโซลิด (eperezolid) ผลิตก่อนที่จะผลิตเพื่อจำหน่ายในท้องตลาด) นั้นต้องใช้ระยะเวลาผลิตที่ยาวนาน และสารเคมีตั้งต้นนั้นมีราคาแพง เช่น แพลเลเดียมบนถ่านกัมมันต์ (en), ตัวทำปฏิกิริยาความไวสูงมีเธนซัลโฟนิลคลอไรด์ (en) และ n-butyllithium และการสังเคราะห์จำเป็นต้องทำในสภาพที่มีอุณหภูมิต่ำ ก้วยเหตุที่กระบวนการสังเคราะห์ไลนิโซลิดนั้นมีต้นทุนที่สูงทำให้ราคายาตามท้องตลาดนั้นอยู่ในระดับที่สูงมากเช่นกัน อย่างไรก็ตาม บริษัทอัพจอห์นสามารถคิดค้นกระบวนการผลิตที่ใช้ระยะเวลาและต้นทุนน้อยลงกว่าวิธีดั้งเดิมสำเร็จ ซึ่งเหมาะสำหรับการผลิตในระดับอุตสาหกรรม และทางบริษัทได้ยื่นขอจดสิทธิบัตรกระบวนการการผลิตดังกล่าวในปี ค.ศ. 1998
การสังเคราะห์ไลนิโซลิดในช่วงหลัง ได้แก่ วิธี atom economy ซึ่งใช้ D-mannitol เป็นสารแรกเริ่ม ถูกคิดค้นและพัฒนาขึ้นในปี ค.ศ. 1999 โดยบริษัทยาสัญชาติอินเดีย ชื่อ Dr. Reddy's Laboratories และการผลิตจากสารตั้งต้น (S) -glyceraldehyde acetonide (เตรียมได้จากไวตามินซี) ที่ถูกพัฒนาขึ้นโดยทีมนักวิจัยจากมหาวิทยาลัยหูหนาน, นครฉางชา, มณฑลหูหนาน, ประเทศจีน. ในวันที่ 25 มิถุนายน ค.ศ. 2008 ระหว่างการประชุมวิชาการเคมีและวิศวกรรมสีเขียวประจำปี ครั้งที่ 12 (12th Annual Green Chemistry and Engineering Conference) ในนครนิวยอร์ก ไฟเซอร์ได้รายงานว่าทางบริษัทสามารถพัฒนาการสังเคราะห์ไลนิโซลิด รุ่นที่สอง ของบริษัทได้สำเร็จ โดยใช้วิธีการสังเคราะห์แบบการสังเคราะห์โดยเริ่มจากภายนอกสู่ภายใน (convergent synthesis) และเป็นการสังเคราะห์แบบเคมีสีเขียว (green chemistry) โดยมีสารตั้งต้นคือ (S) -epichlorohydrin ซึ่งให้ผลผลิตสูงถึงร้อยละ 56 อีกทั้งยังมีของเสียจากกระบวนการผลิตลดน้อยลงจากวิธีเดิม
การดื้อยา
การดื้อต่อยาไลนิโซลิดเริ่มมีรายงานแต่ช่วงต้น ค.ศ. 1999 ในผู้ป่วยขั้นรุนแรงจำนวน 2 รายที่ติดเชื้อ Enterococcus faecium ที่ดื้อต่อยาปฏิชีวนะหลายขนาน รวมไปถึงไลนิโซลิด ทำให้ผู้ป่วยสองรายนี้ต้องได้รับการรักษาด้วยโปรแกรมการรักษาทางเลือก (expanded access) ซึ่งหมายถึงการใช้ยาใหม่ที่ยังไม่ได้การรับรองให้ใช้ในเวชปฏิบัติสำหรับมนุษย์ (Investigational New Drug) ส่วนการดื้อต่อยาไลนีโซลิดของเชื้อ Staphylococcus aureus พบการรายงานครั้งแรกเมื่อปี ค.ศ. 2001
ในสหรัฐอเมริกา การดื้อต่อยาไลนิโซลิดได้รับการติดตามและบันทึกมาตั้งแต่ ค.ศ. 2004 ผ่านโครงการที่มีชื่อว่า LEADER ซึ่งได้ดำเนินโครงการดังกล่าวสถาบันทางการแพทย์กว่า 60 แห่งทั่วประเทศ (ข้อมูลเมื่อ 2007) อัตราการดื้อต่อไลนิโซลิดนั้นยังคงคงที่และและค่อนข้างต่ำ โดนคิดเป็นสัดส่วนที่น้อยกว่าร้อยละ 0.5 ของเชื้อทั้งหมดที่คัดแยกได้ และน้อยกว่าร้อยละ 0.1 ของเชื้อ S. aureus ที่เพาะได้จากผู้ป่วย เช่นเดียวกันกับโครงการ "การศึกษาประสิทธิศักย์และความกว้างการรักษาของยาไซว็อกซ์" (Zyvox Annual Appraisal of Potency and Spectrum Study: ZAAPS) ที่ดำเนินโครงการในหลายประเทศทั่วโลกตั้งแต่ปี ค.ศ. 2002 พบว่า ข้อมูลเมื่อ 2007 สัดส่วนการดื้อต่อไลเนโวลิดของเชื้อแบคทีเรียใน 23 ประเทศทั่วโลกนั้นน้อยกว่าร้อยละ 0.2 และไม่พบการดื้อต่อยาของเชื้อแบคทีเรียสกุลสเตรปโตคอกคัส (streptococci) ทั้งนี้ การดื้อยาพบเพียงเฉพาะในประเทศบราซิล จีน ไอร์แลนด์ อิตาลีเท่านั้น โดยเชื้อแบคทีเรียที่ดื้อต่อไลนิโซลิดที่พบในโครงการนี้สามารถจำแนกออกได้เป็น Coagulase-negative Staphylococci (ร้อยละ 0.28 ของการดื้อต่อไลนิโซลิดทั้งหมด), เอนเทอโรคอคคัส (ร้อยละ 0.11) และ S. aureus (ร้อยละ 0.03) สำหรับในสหราชอาณาจักรและไอร์แลนด์ไม่พบการดื้อยาของเชื้อแบคทีเรียสกุลสแตฟฟิโลคอคคัสที่เก็บตัวอย่างจากผู้ป่วยติดเชื้อแบคทีเรียระหว่างปี ค.ศ. 2001 ถึง 2006 แต่ก็มีรายงานการเกิดการดื้อยาของเชื้อแบคทีเรียสกุลเอนเทอโรคอคคัส ทั้งนี้ นักวิจัยบางคนได้คาดการณ์ไว้ว่า การดื้อของเชื้อ E. faecium ต่อไลนิโซลิดจะมีจำนวนเพิ่มมากยิ่งขึ้นหากยังมีการใช้ยานี้อย่างต่อเนื่องทั้งในกรณีที่มีปริมาณการใช้เทียบเท่ากับปัจจุบันหรือเพิ่มขึ้นในอนาคต แต่อย่างไรก็ตาม ในปัจจุบันไลนิโซลิดก็ยังเป็นยาปฏิชีวนะสำคัญอีกชนิดหนึ่งที่มีอัตราสำเร็จในการรักษาเกือบสมบูรณ์ (มีการดื้อยาเพียงร้อยละ 0.05).
กลไกการดื้อยา
การดื้อยาโดยธรรมชาติ (intrinsic resistance) ของแบคทีเรียแกรมลบ ต่อไลนิโซลิดมีสาเหตุเนื่องมาจากการผลักยาออกจากเซลล์ของเชื้อแบคทีเรีย ซึ่งการผลักออกจากเซลล์นี้จะเกิดได้ในอัตราที่รวดเร็วกว่าการสะสมยาสู่เซลล์
โดยทั่วไปแล้ว แบคทีเรียแกรมบวก มักพัฒนากระบวนการการดื้อต่อยาไลนิโซลิดจากกระบวนการกลายพันธุ์ของยีนในตำแหน่ง G2576T ซึ่งเบสกวานีนจะแทนที่ด้วยเบสไทอามีน ในคู่เบสลำดับที่ 2576 ของการถอดรหัสสำหรับการสร้าง 23S ไรโบโซมอลอาร์เอ็นเอ โดยกลไกนี้เป็นกลไกการดื้อต่อยาปฏิชีวนะปกติของเชื้อแบคทีเรียสกุลสแตฟฟิโลคอคคัสสแตรฟิโลคอกคัส และเป็นเพียงกลไกลเดียวที่เชื้อ E. faecium ดื้อต่อยานี้เท่าที่ค้นพบจนถึงปัจจุบัน กลไกการดื้อยาอื่นๆได้รับการชี้ชัดจากเชื้อ Streptococcus pneumoniae (รวมไปถึงการกลายพันธุ์ของยีนที่ควบคุมการสร้างเอนไซม์อาร์เอ็นเอเมทิลทรานส์เฟอเรสที่ตำแหน่ง G2445 ของ 23S ไรโบโซมอลอาร์เอ็นเอ และการกลายพันธุ์ที่เป็นสาเหตุให้เกิดการเพิ่มขึ้นของการแสดงออกของยีนขนส่งเอบีซี ( ABC transporter) และใน Staphylococcus epidermidis
ประวัติและการค้นพบ
สารกลุ่มออกซาโซลิไดโอน เป็นที่รู้จักกันในช่วงปลายทศวรรษ 1950 ว่าเป็นสารในกลุ่มที่มีฤทธิ์ยับยั้งการทำงานของเอนไซม์มอนอเอมีนออกซิเดส (monoamine oxidase inhibitors) ต่อมาในทศวรรษที่ 1970 ทีมนักวิจัยในบริษัท อี.ไอ. ดูปองต์เดอเนอมูร์ ได้ค้นพบว่าสารกลุ่มดังกล่าวมีคุณสมบัติในการต้านเชื้อแบคทีเรีย ในปี ค.ศ. 1978 บริษัทดูปองต์ได้จดสิทธิบัตรสารประกอบกลุ่มออกซาโซลิไดโอนหลายชนิดสำหรับการรักษาโรคติดเชื้อแบคทีเรียและโรคติดเชื้อราในพืช และในปี ค.ศ. 1984 ได้จดสิทธิบัตรเพิ่มเติมสำหรับการใช้สารกลุ่มดังกล่าวในการรักษาการติดเชื้อแบคทีเรียในสัตว์เลี้ยงลูกด้วยนม ต่อมาปี ค.ศ. 1987 นักวิทยาศาสตร์ของบริษัทดูปองต์ได้บันทึกรายงานโดยจัดให้สารประกอบกลุ่มออกซาโซลิไดโอนเป็นกลุ่มของยาปฏิชีวนะกลุ่มใหม่ เนื่องจากมีกลไกการออกฤทธิ์ที่แตกต่างจากยาปฏิชีวนะชนิดอื่นที่มีอยู่เดิม อย่างไรก็ตาม สารประกอบกลุ่มที่ค้นพบในช่วงแรกเริ่มนั้นพบว่ามีส่วนเหนี่ยวนำให้เกิดภาวะตับอักเสบ ทำให้การพัฒนายากลุ่มนี้หยุดชะงักลง
ในช่วงทศวรรษที่ 1990 บริษัทฟาร์มาเซียแอนด์อัพจอห์น (Pharmacia & Upjohn) ซึ่งปัจจุบันเป็นส่วนหนึ่งของไฟเซอร์ ได้เริ่มโครงการวิจัยและพัฒนายากลุ่มออกซาโซลิไดโอนขึ้น การศึกษาความสัมพันธ์ระหว่างโครงสร้างและการออกฤทธิ์ของสารประกอบกลุ่มดังกล่าวนำไปสู่การพัฒนายาในกลุ่มย่อยของอนุพันธ์ออกซาโซลิไดโอนหลากหลายชนิด ซึ่งมีคุณสมบัติในการต้านเชื้อแบคทีเรียและความปลอดภัยแตกต่างกัน จนท้ายที่สุดได้สารประกอบสองชนิดที่มีความเหมาะสมที่จะพัฒนาต่อเป็นยาปฏิชีวนะได้ คือ อีพีริโซลิด (en) (ชื่อรหัส PNU-100592) และไลนิโซลิด (PNU-100766). ในการพัฒนาช่วงก่อนการทดลองในมนุษย์ ยาทั้งสองชนิดนั้นมีความปลอดภัยและประสิทธิภาพในการต้านเชื้อแบคทีเรียคล้ายคลึงกัน แต่เมื่อเข้าสู่การวิจัยทางคลินิกในขั้นที่ 1 เพื่อจำแนกความแตกต่างทางด้านเภสัชจลนศาสตร์ของยาทั้งสอง พบว่าไลนิโซลิดมีคุณสมบัติด้านเภสัชจลนศาสตร์ที่ดีกว่า คือ มีความถี่ในการบริหารยาเพียงวันละ 2 ครั้ง ขณะที่อีพีริโซลิดนั้นต้องบริหารยาวันละ 3 ครั้งถึงจะมีประสิทธิภาพเทียบเท่ากับไลนิโซลิด ดังนั้นไลนิโซลิดจึงได้รับการพัฒนาต่อในการวิจัยทางคลินิกขั้นต่อไป หลังสิ้นสุดกระบวนศึกษาทางคลินิกต่างๆครบถ้วนแล้ว องค์การอาหารและยาแห่งสหรัฐอเมริกา ได้ขึ้นทะเบียนไลนิโซลิดเป็นยาปฏิชีวนะในวันที่ 18 เมษายน ค.ศ. 2000 ตามด้วยบราซิลในเดือนมิถุนายนปีเดียวกัน, สหราชอาณาจักร (มกราคม 2001), ญี่ปุ่นและแคนาดา (มีนาคม 2001), ยุโรป (ตลอดปี 2001), และประเทศอื่นอีกหลายประเทศทั้งในละตินอเมริกาและเอเชีย
ข้อมูลเมื่อ 2009 ไลนิโซลิดเป็นยาปฏิชีวนะกลุ่มออกซาโซลิไดโอนเพียงชนิดเดียวที่ได้รับการรับรองให้ใช้ในมนุษย์ ส่วนยาอื่นในกลุ่มนี้นั้นล้วนอยู่ในขั้นตอนการศึกษาวิจัย เช่น โพซิโซลิด (posizolid หรือ AZD2563),แรนบีโซลิด (ranbezolid หรือ RBx 7644),โทรีโซลิด (torezolid หรือTR-701), และ ราดีโซลิด (radezolid หรือ RX-1741)
สังคมและวัฒนธรรม
เภสัชเศรษฐศาสตร์
ในปี ค.ศ. 2009 ไลนิโซลิดจัดเป็นยาปฏิชีวนะที่มีราคาค่อนข้างสูง โดยการรักษาในรอบหนึ่งๆ อาจมีใช้ค่าใช้จ่ายเฉพาะค่ายาชนิดนี้มากถึง 1000 – 2000 ดอลลาร์สหรัฐ ซึ่งยังไม่รวมค่าใช้จ่ายอื่นๆ (อาทิ ค่าใช้จ่ายที่เกี่ยวเนื่องกับการเข้าพักรักษาในโรงพยาบาล) อย่างไรก็ดี เมื่อยานี้มีการใช้ในวงกว้างมากขึ้น ทำให้ค่าใช้จ่ายด้านยาในการรักษารอบหนึ่งๆ ในสหรัฐอเมริกาลดลงเป็นอย่างมาจาก โดยในปี ค.ศ. 2016 ค่าใช้จ่ายดังกล่าวอยู่ที่ประมาณ 137.90 ดอลลาร์สหรัฐ ในประเทศอินเดีย จากข้อมูลปี ค.ศ. 2015 การได้รับการรักษาด้วยไลเนโวลิด ซึ่งส่วนใหญ่ใช้สำหรับการรักษาวัณโรค เป็นระยะเวลา 1 เดือนจะมีค่าใช้จ่ายเฉพาะยานี้เพียง 137.90 ดอลลาร์สหรัฐ นอกจากนี้แล้ว เนื่องจากการบริหารยาไลนิโซลิดนั้นสามารถปรับเปลี่ยนวิธีการบริหารยาจากการฉีดเข้าหลอดเลือดดำเป็นการรับประทานทั้งในรูปแบบยาเม็ดหรือยาน้ำได้โดยไม่มีผลต่อประสิทธิภาพการรักษา ทำให้ผู้ป่วยอาจออกจากโรงพยาบาลได้เร็วขึ้นและทำการรักษาต่อที่บ้านโดยการใช้ยาในรูปแบบรับประทาน ซึ่งการลดระยะเวลาการพักรักษาในโรงพยาบาลเช่นนี้ก็ช่วยลดค่าใช้จ่ายรวมของการรักษาแม้ไลนีโซลิดจะมีราคาสูงก็ตามเมื่อเปรียบเทียบกับยาปฏิชีวนะขนานอื่นๆก็ตาม
ทั้งนี้ การศึกษาวิจัยในหลายประเทศพบว่า มีความแตกต่างของระบบที่ใช้ในการประเมินต้นทุน – ประสิทธิผล (cost-effectiveness analysis) ของไลนิโซลิดเทียบกับยากลุ่มไกลโคเปปไทด์ เช่น แวนโคมัยซิน หรือไทโคพลานิน ผลการวิเคราะห์พบว่า ในการรักษาโรคปอดอักเสบชุมชน และ การติดเชื้อแบคทีเรียที่ผิวหนังและโครงสร้างผิวหนังแบบซับซ้อน (complicated skin and skin structure infection) ส่วนมากไลนิโซลิดจะมีความคุ้มค่าในเชิงต้นทุน – ประสิทธิผลมากกว่ายาปฏิชีวนะอื่นข้างต้น ซึ่งอาจเป็นผลมาจากทั้งอัตราการรักษาหายขาดและอัตราการรอดชีวิตที่สูงกว่า และค่ารักษาพยาบาลรวมทั้งหมดที่ต่ำกว่า
ในปี ค.ศ. 2009 ไฟเซอร์ได้จ่ายเงิน 2.3 พันล้านดอลลาร์สหรัฐ เพื่อคลี่คลายข้อกล่าวหาทางแพ่งและทางอาญาที่เกิดขึ้นเนื่องจากการส่งเสริมการขายที่ขัดต่อข้อตกลงเกี่ยวกับความมีคุณธรรมขององค์กร (Corporate Integrity Agreement; CIA) ของสำนักงานผู้ตรวจการสูงสุดของกระทรวงบริการเกี่ยวกับสุขภาพและมนุษย์แห่งสหรัฐอเมริกา (U.S. Office of Inspector General of the Department of Health and Human Services; OIG) โดยไฟเซอร์ได้ถูกกล่าวหาว่ามีเจตนาหลอกลวงให้เกิดความเข้าใจผิดในยาที่ต่างชนิดกัน, ส่งเสริมการขายยาที่มีขนาดสูงเกินไป รวมไปถึงมีการส่งเสริมการขายยาอื่นอย่างผิดกฎหมาย จำนวนทั้งสิ้น 4 ขนาน ซึ่ง 1 ในนั้นคือยาไลนิโซลิด โดยในเงินจำนวนนี้ 1.3 พันล้านดอลลาร์สหรัฐ เป็นค่าปรับข้อหาเจตนาหลอกลวงให้เกิดความเข้าใจผิดในยาชื่อการค้า Bextra (ชื่อสามัญทางยาคือ วาลดีคอกซิบ) ในขณะที่ 1 พันล้านเหรียญสหรัฐเป็นค่าปรับในการส่งเสริมการขายยาที่ผิดกฎหมายจำนวน 3 รายการที่เหลือ โดยหนึ่งในนั้นคือ Zyvox ซึ่งเป็นชื่อการค้าของไลนิโซลิด
ชื่อการค้า
ปัจจุบัน ยาต้นแบบไลนิโซลิดที่ถูกผลิตออกสู่ท้องตลาดทั่วโลกโดยไฟเซอร์ นั้นมีการใช้ชื่อการค้าที่แตกต่างกัน ได้แก่ Zyvox (ในสหรัฐอเมริกา, สหราชอาณาจักร, ออสเตรเลีย, และประเทศอื่นๆ), Zyvoxid (ในยุโรป), และ Zyvoxam (ในแคนาดาและเม็กซิโก) ส่วนยาสามัญที่ผลิตออกสู่ท้องตลาดโดยบริษัทอื่นๆ เช่น Linezomentin (ในอียิปต์ โดยบริษัท Arabcomed), Lenzomore (ในอินเดีย โดยบริษัท Morepen), Linospan (ในอินเดีย โดยบริษัท Cipla), Nezocin (ในปากีสถาน โดยบริษัท Brookes), Voxazoldin (ในอียิปต์ โดยบริษัท Rotabiogen), Lizomed (ในอินเดีย ในรูปแบบยาน้ำเชื่อมชนิดผงแห้ง โดยบริษัท Aglowmed), และ Linzolid (ในบังกลาเทศ โดยบริษัท Incepta).
|
ยาต้านจุลชีพ − ประเด็นด้านสังคมและวัฒนธรรม
| |
|---|---|
| ประเภทของยาต้านจุลชีพ | |
| ประเด็นด้านสังคม | |
| เภสัชวิทยา | |
|
ทางเดินอาหาร/ เมแทบอลิซึม (A) |
กรดกระเพาะ (ยาลดกรด, สารต้านตัวรับ H2 , ยายับยั้งการหลั่งกรด) • ยาแก้อาเจียน • ยาระบาย • ยาแก้ท้องร่วง • ยาลดความอ้วน • ยาต้านเบาหวาน • วิตามิน • เกลือแร่
|
|---|---|
|
เลือดและอวัยวะ สร้างเลือด (B) |
|
|
ระบบหัวใจ และหลอดเลือด (C) |
ยารักษาโรคหัวใจ/ยาแก้อาการปวดเค้นหัวใจ (คาร์ดิแอคไกลโคไซด์ , ยาต้านภาวะหัวใจเสียจังหวะ , ยากระตุ้นหัวใจ) • ยาลดความดัน • ยาขับปัสสาวะ • สารขยายหลอดเลือด • เบต้า บล็อกเกอร์ • แคลเซียมแชนแนลบล็อกเกอร์ • ระบบเรนิน-แองจิโอเทนซิน (เอซีอีอินฮิบิเตอร์ , แองกิโอเทนซินรีเซพเตอร์บล๊อคเกอร์ , เรนินอินฮิบิเตอร์) • ยาลดไขมันในเส้นเลือด (สแตติน , ไฟเบรต , ไบล์แอซิดซีเควสแตรนต์) |
| ผิวหนัง (D) | |
| ระบบสืบพันธุ์ (G) | |
| ระบบต่อมไร้ท่อ (H) | |
|
การติดเชื้อและ การติดเชื้อปรสิต (J, P, QI) |
|
| มะเร็ง (L01-L02) | |
| โรคทางระบบ ภูมิคุ้มกัน (L03-L04) |
|
| กล้ามเนื้อ กระดูก และข้อต่อ (M) | |
| สมองและระบบประสาท (N) | |
| ระบบทางเดินหายใจ (R) | |
| อวัยวะรับความรู้สึก (S) | |
| อื่น ๆ (V) | |