โรคอัลไซเมอร์
| โรคอัลไซเมอร์ (Alzheimer's disease) | |
|---|---|
 | |
| แผนภาพเปรียบเทียบระหว่างสมองของผู้สูงอายุปกติ (ซ้าย) และสมองผู้ป่วยโรคอัลไซเมอร์ (ขวา) มีการชี้แสดงลักษณะที่แยกระหว่างทั้งสอง | |
| สาขาวิชา | ประสาทวิทยา |
| อาการ | จำเหตุการณ์ปัจจุบันได้ยาก มีปัญหาด้านภาษา งุนงงสับสน อารมณ์แกว่ง |
| การตั้งต้น | 65 ปีขึ้นไป |
| ระยะดำเนินโรค | ระยะยาว |
| สาเหตุ | ยังเข้าใจไม่มากนัก |
| ปัจจัยเสี่ยง | พันธุกรรม ได้รับบาดเจ็บที่ศีรษะ โรคซึมเศร้า ความดันโลหิตสูง |
| วิธีวินิจฉัย | ยึดอาการและการทดสอบการรู้หลังแยกสาเหตุอื่นที่เป็นไปได้ |
| โรคอื่นที่คล้ายกัน | การเปลี่ยนตามวัยปกติ |
| ยา | สารยับยั้งอะเซทิลโคลีนเอสเตอเรส, สารต้านตัวรับเอ็นเอ็มดีเอ (มีประโยชน์เล็กน้อย) |
| พยากรณ์โรค | อายุคาดหมายคงชีพ 3–9 ปี |
| ความชุก | 29.8 ล้านคน (ปี 2558) |
| การเสียชีวิต | 1.9 ล้านคน (ปี 2558) |
โรคอัลซไฮเมอร์ หรือ โรคอัลไซเมอร์ (อังกฤษ: Alzheimer's disease หรือ AD) เป็นโรคการเสื่อมของระบบประสาทเรื้อรังที่ปกติเริ่มต้นช้า ๆ และค่อย ๆ มีอาการหนักขึ้นตามเวลา เป็นภาวะสมองเสื่อมที่พบได้บ่อยที่สุดคือประมาณ 60–70% อาการเริ่มแรกที่พบบ่อยที่สุดได้แก่ การจำเหตุการณ์ปัจจุบันไม่ค่อยได้ เมื่อโรคลุกลามมากขึ้น อาการอาจมีปัญหาเรื่องการใช้ภาษา ความงุนงงสับสน (รวมทั้งหลงทางง่าย) อารมณ์แกว่ง เสียแรงจูงใจ ไม่ดูแลตนเองและมีปัญหาพฤติกรรม เมื่ออาการของบุคคลเสื่อมลง ผู้ป่วยมักปลีกตัวออกจากครอบครัวและสังคม การทำงานของร่างกายจะค่อย ๆ เสื่อมลงจนนำไปสู่การเสียชีวิตในที่สุด แม้การลุกลามของโรคอาจมีความเร็วแตกต่างกันได้ แต่อายุคาดหมายการคงชีพตรงแบบหลังวินิจฉัยแล้วอยู่ที่ 3 ถึง 9 ปี
ยังไม่ค่อยเข้าใจสาเหตุของโรคอัลไซเมอร์ดีนัก ความเสี่ยงประมาณ 70% เชื่อว่าได้รับมาจากบิดามารดาของผู้ป่วยโดยปกติเกี่ยวข้องกับหลายยีน ปัจจัยเสี่ยงอื่นได้แก่ประวัติได้รับบาดเจ็บที่ศีรษะ โรคซึมเศร้าและความดันโลหิตสูง กระบวนการของโรคสัมพันธ์กับพลาก (plaque) และนิวโรไฟบริลลารีแทงเกิล (neurofibrillary tangle) ในสมอง การวินิจฉัยที่เป็นไปได้อาศัยประวัติความเจ็บป่วยและการทดสอบการรู้ กับการถ่ายภาพทางการแพทย์และการตรวจเลือดเพื่อแยกสาเหตุที่เป็นไปได้อย่างอื่น อาการเริ่มแรกมักเข้าใจผิดว่าเป็นการเปลี่ยนตามวัยปกติ การวินิจฉัยแน่ชัดจำเป็นต้องตรวจเนื้อเยื่อสมองการออกกำลังกายและการฝึกสมอง ตลอดจนการเลี่ยงโรคอ้วนอาจลดความเสี่ยงของโรคอัลไซเมอร์ อย่างไรก็ดี หลักฐานสนับสนุนข้อแนะนำเหล่านี้ยังอ่อนอยู่ ไม่มียาหรืออาหารเสริมที่แสดงว่าลดความเสี่ยงของโรค
ไม่มีการรักษาใดหยุดหรือชะลอการลุกลามของโรค แม้การรักษาบางอย่างอาจลดอาการได้ชั่วคราว ผู้ป่วยจำเป็นต้องพึ่งพาขอความช่วยเหลือผู้ป่วยมากขึ้นเรื่อย ๆ และมักเป็นภาระแก่ผู้ดูแล ความกดดันนี้อาจรวมถึงส่วนสังคม จิตวิทยา กายภาพและเศรษฐกิจ โปรแกรมออกกำลังกายอาจเป็นประโยชน์เกี่ยวกับความสามารถในการประกอบกิจวัตรประจำวันและอาจสามารถปรับปรุงผลลัพธ์ของโรคได้ ปัญหาพฤติกรรมหรือโรคจิตเนื่องจากภาวะสมองเสื่อมมักรักษาด้วยยารักษาโรคจิต แต่ปกติไม่แนะนำ เพราะมีประโยชน์น้อยและเพิ่มความเสี่ยงต่อการเสียชีวิตก่อนวัย
ในปี 2558 มีผู้ป่วยโรคอัลไซเมอร์ประมาณ 29.8 ล้านคนทั่วโลก มักเริ่มในผู้มีอายุตั้งแต่ 65 ปีขึ้นไป แม้ผู้ป่วย 4–5% เป็นโรคอัลไซเมอร์เป็นเร็ว (early-onset Alzheimer's) โรคนี้เกิดในผู้มีอายุตั้งแต่ 65 ปีขึ้นไปประมาณ 6% ในปี 2558 โรคอัลไซเมอร์เป็นสาเหตุของการเสียชีวิต 1.9 ล้านครั้ง จิตแพทย์และนักพยาธิวิทยาชาวเยอรมัน อาลัวส์ อัลซ์ไฮเมอร์ เป็นผู้ค้นพบโรคดังกล่าวในปี 2449 และโรคนี้ได้ชื่อตามเขา ในประเทศพัฒนาแล้ว โรคอัลไซเมอร์เป็นโรคที่มีมูลค่าทางการเงินสูงสุดโรคหนึ่ง
อาการ
- ผลของการเปลี่ยนตามวัยต่อความจำ (ไม่ใช่ AD)
- หลงลืมบ้างเป็นครั้งคราว
- วางสิ่งของผิดที่บางครั้ง
- เสียความจำระยะสั้นเล็กน้อย
- จำรายละเอียดแน่ชัดไม่ได้
- อัลไซเมอร์ระยะแรก
- จำไม่ได้ว่าลืมเป็นคราว ๆ
- ลืมชื่อของครอบครัวหรือมิตรสหาย
- เพื่อนหรือญาติใกล้ชิตอาจสังเกตการเปลี่ยนแปลงได้
- สับสนบ้างในสถานการณ์ที่ไม่ค่อยคุ้นเคย
- อัลไซเมอร์ระยะกลาง
- จำสารสนเทศที่เพิ่งเรียนรู้ยากยิ่งขึ้น
- สับสนเพิ่มขึ้นในหลายสถานการณ์
- มีปัญหาการหลับ
- มีปัญหาในการระบุตำแหน่งของตนเอง
- อัลไซเมอร์ระยะท้าย
- มีความสามารถในการคิดต่ำ
- พูดลำบาก
- สนทนาแบบเดิมซ้ำ
- ก้าวร้าว กระวนกระวายหรือหวาดระแวงมากขึ้น
การดำเนินโรคอัลไซเมอร์แบ่งออกเป็น 4 ระยะ โดยมีแบบรูปความเสื่อมของการรู้และหน้าที่แบบลุกลาม
ระยะก่อนสมองเสื่อม
อาการแรกสุดมักเข้าใจผิดว่าเกิดขึ้นเองจากการเปลี่ยนตามวัย หรือเกิดจากภาวะเครียด การทดสอบทางจิตประสาทวิทยาอย่างละเอียดอาจแสดงความบกพร่องทางการรู้เล็กน้อย ซึ่งอาจพบได้ 8 ปีก่อนผู้ป่วยครบตามเกณฑ์ทางคลินิกสำหรับการวินิจฉัยโรคอัลไซเมอร์ อาการเริ่มแรกจะมีผลกระทบต่อความสามารถในกิจวัตรประจำวันที่ซับซ้อนส่วนใหญ่ ความบกพร่องที่เห็นชัดมากที่สุดคือการเสียความจำระยะสั้น ซึ่งปรากฏเป็นการจำข้อเท็จจริงที่เพิ่งรู้มาหมาด ๆ ได้ยาก และไม่สามารถรับสารสนเทศใหม่ได้
ปัญหาที่ตรวจจับได้ยากเกี่ยวกับหน้าที่การบริหารจัดการ อาทิความใส่ใจ, การวางแผน, ความยืดหยุ่น และความคิดเชิงนามธรรม หรือความบกพร่องของความจำเชิงอรรถศาสตร์ (การจำความหมายและความสัมพันธ์เชิงแนวคิด) อาจปรากฏอาการได้ในโรคอัลไซเมอร์ระยะแรก อาจพบภาวะไร้อารมณ์ได้ในระยะนี้และจะเป็นอาการทางจิตประสาทที่คงอยู่มากที่สุดตลอดระยะการดำเนินโรค อาการโรคซึมเศร้า ความหงุดหงิดและการรับรู้ความลำบากในการจำที่ตรวจจับได้ยากก็พบได้บ่อย ระยะก่อนคลินิกของโรคยังเรียกอีกอย่างว่า "ความบกพร่องทางการรู้เล็กน้อย" (MCI) ซักมักพบว่าเป็นระยะเปลี่ยนผ่านระหว่างการเปลี่ยนตามวัยปกติกับภาวะสมองเสื่อม MCI อาจปรากฏอาการได้หลากหลาย และเมื่อการเสียความจำเป็นอาการเด่น จึงเรียกว่า "MCI ความจำเสื่อม" และมักพบว่าเป็นระยะบอกล่วงหน้าโรคอัลไซเมอร์
สมองเสื่อมระยะแรก
ผู้ป่วยโรคอัลไซเมอร์จะมีความบกพร่องของความจำและการเรียนรู้มากขึ้นเรื่อย ๆ จนสามารถวินิจฉัยอย่างแน่นอนได้ ผู้ป่วยจำนวนน้อยมีอาการบกพร่องทางภาษา หน้าที่การบริหาร การกำหนดรู้ (ภาวะเสียการระลึกรู้) หรือภาวะเสียการรู้ปฏิบัติเด่นกว่าปัญหาด้านความจำ โรคอัลไซเมอร์ไม่มีผลกระทบต่อความสามารถด้านความจำทั้งหมดเท่า ๆ กัน โดยความทรงจำระยะยาวของชีวิตผู้ป่วย (ความจำเชิงเหตุการณ์) ข้อเท็จจริงที่เรียนมา (ความจำเชิงอรรถศาสตร์) และความจำโดยปริยาย (implicit memory) คือ ความจำของร่างกายว่าทำสิ่งต่าง ๆ อย่างไร เช่น การใช้ช้อนส้อมรับประทานอาหาร) ล้วนได้รับผลกระทบน้อยกว่าความจำหรือความรู้ใหม่
ปัญหาทางภาษามีลักษณะเด่นคือการรวบคำให้สั้นและพูดหรือใช้ศัพท์ไม่ฉะฉานเหมือนเดิม ซึ่งทำให้ใช้ภาษาพูดหรือเขียนน้อยลง ในระยะนี้ปกติผู้ป่วยโรคอัลไซเมอร์ยังสามารถสื่อสารความคิดพื้นฐานได้เพียงพอ เมื่อผู้ป่วยมีการกล้ามเนื้อมัดเล็ก เช่น การเขียน วาดภาพ หรือแต่งกาย อาจพบความบกพร่องของการประสานการเคลื่อนไหวและการวางแผน (ภาวะเสียการรู้ปฏิบัติ) บ้าง แต่โดยทั่วไปยังจับไม่ได้ เมื่อโรคดำเนินต่อไปผู้ป่วยโรคอัลไซเมอร์มักสามารถทำงานหลายอย่างได้ด้วยตัวเองแต่อาจต้องได้รับการช่วยเหลือหรือการกำกับสำหรับกิจกรรมที่ต้องอาศัยกระบวนการรู้อย่างมาก
สมองเสื่อมระยะปานกลาง
ในระยะนี้สมองจะเสื่อมลงเรื่อย ๆ จนสุดท้ายไม่สามารถพึ่งตนเองได้ โดยไม่สามารถประกอบกิจวัตรประจำวันส่วนใหญ่ได้ อาการพูดลำบากจะชัดเจนเพราะไม่สามารถนึกคำศัพท์ได้ ทำให้ใช้ศัพท์ผิดหรือใช้คำอื่นมาแทน (paraphasia) บ่อย ผู้ป่วยค่อย ๆ เสียทักษะการอ่านและการเขียนมากขึ้น ลำดับการเคลื่อนไหวที่ซับซ้อนจะมีการประสานงานลดลงเรื่อย ๆ ตามการลุกลามของโรคอัลไซเมอร์ ทำให้ความเสี่ยงต่อการหกล้มเพิ่มขึ้นไปด้วย ในระยะนี้ปัญหาความจำของผู้ป่วยจะเลวลง และผู้ป่วยอาจจำไม่ได้แม้แต่ญาติสนิทของตนเองความทรงจำระยะยาวซึ่งแต่เดิมยังปกติอยู่ ก็บกพร่อง
การเปลี่ยนแปลงพฤติกรรมและจิตประสาทวิทยาพบมากขึ้น อาการแสดงทั่วไปได้แก่ การหนีออกจากบ้าน ความหงุดหงิดและไม่ล่องตัว ทำให้ร้องไห้ มีความก้าวร้าวอย่างไม่คาดคิดฉับพลัน หรือดื้อกับผู้ดูแล อาการสับสนหรือเห็นภาพหลอนในเวลากลางคืน (sundowning) ก็มีได้ ผู้ป่วยโรคอัลไซเมอร์ประมาณ 30% มีอาการเชื่อว่าบุคคล สิ่งของ หรือสถานที่เปลี่ยนแปลงไป (เรียกว่า Delusional misidentification syndrome) และอาจมีอาการหลงผิดอย่างอื่น ผู้ป่วยอาจเสียวิจารณญาณต่อกระบวนการและข้อจำกัดของโรค (ภาวะเสียสำนึกความพิการ) อาจกลั้นปัสสาวะไม่ได้ อาการเหล่านี้ทำให้เกิดความเครียดต่อผู้ดูแลและญาติ ซึ่งอาจลดความเครียดดังกล่าวโดยการย้ายผู้ป่วยจากบ้านไปยังถานดูแลระยะยาวอื่น
สมองเสื่อมระยะสุดท้าย
ในระยะสุดท้าย ผู้ป่วยต้องพึ่งพาผู้ดูแลตลอดเวลา ทักษะทางภาษาของผู้ป่วยลดลงเหลือวลีง่าย ๆ หรือคำเดี่ยว ๆ จนสุดท้ายไม่สามารถพูดได้โดยสิ้นเชิง แม้ว่าผู้ป่วยเสียความสามารถด้านภาษาพูด แต่ยังมักเข้าใจและตอบสนองกลับมาด้วยการแสดงอารมณ์ แม้ผู้ป่วยยังมีลักษณะก้าวร้าว แต่ภาวะไร้อารมณ์สุดขั้วและอ่อนเพลียเป็นอาการที่พบมากกว่า ในที่สุดผู้ป่วยจะไม่สามารถทำกิจกรรมใดได้เลยแม้เป็นกิจกรรมง่ายที่สุดหากขาดผู้ช่วยเหลือ มวลกล้ามเนื้อและการเคลื่อนไหวร่างกายลดลงจนผู้ป่วยติดเตียง และไม่สามารถป้อนอาหารด้วยตนเองได้ ปกติสาเหตุการเสียชีวิตเป็นปัจจัยภายนอก เช่น แผลกดทับติดเชื้อหรือโรคปอดบวม ไม่ใช่เสียชีวิตจากโรคอัลไซเมอร์โดยตรง
สาเหตุ
ยังไม่ทราบสาเหตุของผู้ป่วยโรคอัลไซเมอร์ส่วนใหญ่ ยกเว้นผู้ป่วย 1% ถึง 5% ที่สามารถระบุข้อแตกต่างทางพันธุกรรมได้ มีสมมติฐานหลายอย่างเพื่อพยายามอธิบายสาเหตุของโรค
พันธุศาสตร์
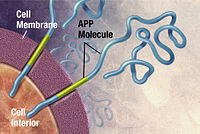
โรคอัลไซเมอร์ (และส่วนประกอบความจำจากโรค) ถ่ายทอดทางพันธุกรรมได้ในช่วง 49% ถึง 79% โดยอาศัยการทบทวนการศึกษาฝาแฝดและครอบครัว ผู้ป่วยประมาณ 0.1% มีรูปแบบทายกรรมลักษณะเด่นในวงศ์ตระกูล ซึ่งมีอายุเริ่มต้นก่อนอายุ 65 ปี โรคอัลไซเมอร์แบบนี้เรียก โรคอัลไซเมอร์ในวงศ์ตระกูลเกิดเร็ว โรคอัลไซเมอร์เกิดเร็วส่วนใหญ่ระบุสาเหตุได้ว่าเกิดจากการกลายพันธุ์ยีนตัวหนึ่งในบรรดาสามตัว คือ ยีนเข้ารหัสโปรตีนสารตั้งต้นแอมีลอยด์ (APP) และพรีเซนิลิน 1 และ 2 การกลายพันธุ์ของยีน APP และพรีเซนิลินเพิ่มการผลิตโปรตีนขนาดเล็ก ชื่อ เอบีตา42 (Aβ42) ซึ่งเป็นองค์ประกอบหลักในซีไนล์พลาก (senile plaque) การกลายพันธุ์บางอย่างเพียงแต่เปลี่ยนแปลงอัตราส่วนระหว่าง Aβ42 และโปรตีนแบบสำคัญอย่างอื่น โดยเฉพาะเอบีตา40 (Aβ40) เท่านั้นโดยไม่เพิ่มระดับ Aβ42 อีกสองยีนที่สัมพันธ์กับโรคอัลไซเมอร์ทายกรรมลักษณะเด่น ได้แก่ ABCA7 และ SORL1
ผู้ป่วยโรคอัลไซเมอร์ส่วนใหญ่ไม่ได้แสดงทายกรรมลักษณะเด่น และเรียกว่า อัลไซเมอร์เกิดห่าง ๆ (sporadic AD) ซึ่งความแตกต่างทางสิ่งแวดล้อมและพันธุกรรมอาจเป็นปัจจัยเสี่ยง ปัจจัยเสี่ยงทางพันธุกรรมที่ทราบดีที่สุด คือ ทายกรรมแอลลีลเอปไซลอน4 ของอะโปไลโปโปรตีนอี (APOE) ผู้ป่วยโรคอัลไซเมอร์ระหว่าง 40 ถึง 80% มีแอลลีล APOEε4 อย่างน้อยหนึ่งแอลลีล แอลลีล APOEε เพิ่มความเสี่ยงของโรคสามเท่าในเฮเทอโรไซโกต และ 15 เท่าในโฮโมไซโกต ผลของสิ่งแวดล้อมและตัวดัดแปรพันธุกรรมทำให้เกิดเพเนแทรนซ์ไม่สมบูรณ์ซึ่งเหมือนกับโรคในมนุษย์หลายชนิด ตัวอย่างเช่น ประชากรไนจีเรียมไแสดงความสัมพันธ์ระหว่างปริมาณ APOEε4 กับอุบัติการณ์หรืออายุเริ่มเป็นโรคอัลไซเมอร์ดังที่เห็นได้ในกลุ่มประชากรอื่น ความพยายามแรก ๆ ในการคัดกรองยีนที่อาจเป็นสาเหตุ 400 ยีนเพื่อหาความสัมพันธ์กับ AD เกิดห่าง ๆ และเกิดช้า (LOAD) ได้ผลลัพธ์เล็กน้อย การศึกษาความสัมพันธ์ทั้งจีโนมล่าสุดพบว่ามียีน 19 บริเวณที่ดูมีผลต่อความเสี่ยง ยีนเหล่านี้ได้แก่ CASS4, CELF1, FERMT2, HLA-DRB5, INPP5D, MEF2C, NME8, PTK2B, SORL1, ZCWPW1, SlC24A4, CLU, PICALM, CR1, BIN1, MS4A, ABCA7, EPHA1, และ CD2AP
แอลลีลในยีน TREM2 สัมพันธ์กับความเสี่ยงเกิดโรคอัลไซเมอร์ 3 ถึง 5 เท่า กลไกการออกฤทธิ์ที่มีการเสนอคือการผันแปรบางอย่างของ TREM2 ในเซลล์เม็ดเลือดขาวในสมองไม่สามารถควบคุมปริมาณของบีตาแอมีลอยด์ได้ SNP จำนวนมากมีความสัมพันธ์กับการศึกษาในปี 2561 ที่เติม SNP 30 ชนิดเพื่อแยก AD ออกเป็น 6 หมวด ได้แก่ ความจำ ภาษา ภาพและปริภูมิ และหน้าที่บริหาร
สมมติฐานโคลิเนอร์จิก
สมมติฐานเก่าที่สุดซึ่งการรักษาด้วยยาปัจจุบันพบมากที่สุดยึดเป็นพื้นฐาน ได้แก่ สมมติฐานโคลิเนอร์จิก (cholinergic hypothesis) ซึ่งเสนอว่าโรคอัลไซเมอร์เกิดจากการสังเคราะห์สารสื่อประสาทชนิดแอซิทิลโคลีน (acetylcholine) ลดลง สมมติฐานดังกล่าวปัจจุบันไม่ได้รับการสนับสนุนอย่างกว้างขวางแล้ว เนื่องจากการให้ยาเพื่อรักษาการขาดแอซิทิลโคลีนโดยตรงไม่มีประสิทธิภาพในการรักษาโรคอัลไซเมอร์มากนัก
สมมติฐานแอมีลอยด์
ในปี 2534 มีการตั้งสมมติฐานแอมีลอยด์ (amyloid hypothesis) ซึ่งมีมูลบทว่าการสะสมของแอมีลอยด์บีตา (amyloid beta; Aβ) เป็นสาเหตุหลักของโรคอัลไซเมอร์ ข้อสนับสนุนมูลบทนี้มาากตำแหน่งของยีนสำหรับโปรตีนสารตั้งต้นแอมีลอยด์ (APP) บนโครโมโซมคู่ที่ 21 ร่วมกับข้อเท็จจริงว่าบุคคลที่มีแฝดสามของโครโมโซม 21 (กลุ่มอาการดาวน์) ซึ่งมีสำเนายีนเกินมาแทบทุกคนอย่างน้อยมีอาการแรกเริ่มของ AD เมื่ออายุย่าง 40 ปี นอกจากนี้ ไอโซฟอร์มจำเพาะหนึ่งของแอโพไลโปโปรตีน APOE4 เป็นปัจจัยเสี่ยงทางพันธุกรรมสำคัญหนึ่งของ AD แม้แอโพไลโปโปรตีนช่วยเสริมการสลายแอมีลอยด์บีตา แต่บางไอโซฟอร์มไม่ค่อยมีประสิทธิภาพในการทำหน้าที่ดังก่าว (เช่น APOE4) นำไปสู่การสะสมแอมีลอยด์ส่วนเกินในสมอง หลักฐานเพิ่มเติมมาจากข้อค้นพบว่าหนูดัดแปลงพันธุกรรมแสดงรูปกลายพันธุ์ของยีน APP ของมนุษย์ก่อให้เกิดพลากแอมีลอยด์แบบสั่นและพยาธิสภาพสมองแบบคล้ายอัลไซเมอร์โดยมีความบกพร่องของการเรียนรู้เชิงปริภูมิ
พบว่าวัคซีนขั้นทดลองชนิดหนึ่งสามารถชำระพลากแอมีลอยด์ในการทดลองในมนุษย์ขั้นต้น แต่ไม่มีผลอย่างมีนัยสำคัญใด ๆ ต่อภาวะสมองเสื่อม นักวิจัยจึงสงสัยว่าโอลิโกเมอร์ Aβ ที่มิใช่พลากเป็น Aβ รูปก่อโรคมากที่สุด โอลิโกเมอร์พิษเหล่านี้ ซึ่งเรียกว่า ไลแกนด์ฤทธิ์สั้นที่ได้จากแอมีลอยด์ (amyloid-derived diffusible ligands) จับกับตัวรับบนผิวเซลล์ประสาทและเปลี่ยนโครงสร้างของจุดประสานประสาท จึงรบกวนการสื่อสารของเซลล์ประสาท ตัวรับโอลิโกเมอร์ Aβ ตัวหนึ่งอาจเป็นโปรตีนพรีออน ซึ่งเป็นเดียวกับโปรตีนที่มีความเชื่อมโยงกับโรควัวบ้าและโรคในมนุษย์ที่เกี่ยวข้อง โรคครอยตส์เฟลดต์-จาค็อบ ฉะนั้นจึงอาจเป็นการเชื่อมโยงกลไกพื้นเดิมของโรคการเสื่อมของระบบประสาทเหล่านี้กับโรคอัลไซเมอร์
ในปี 2552 มีการปรับทฤษฎี โดยเสนอว่าโปรตีนที่สัมพันธ์ใกล้ชิดกับโปรตีนบีตา-แอมีลอยด์ ซึ่งไม่จำเป็นต้องเป็นบีตา-แอมีลอยด์เอง อาจเป็นสาเหตุสำคัญของโรคอัลไซเมอร์ ทฤษฎีนี้เชื่อว่ากลไกที่สัมพันธ์กับแอมีลอยด์ซึ่งตัดการประสานของเซลล์ประสาทในสมองในระยะเติบโตเร็วในปฐมวัยอาจเกิดจากกระบวนการที่สัมพันธ์กับการเปลี่ยนตามวัยในชีวิตภายหลัง ทำให้เกิดความเสื่อมของเซลล์ประสาทในโรคอัลไซเมอร์ N-APP ซึ่งเป็นชิ้นส่วนหนึ่งจากปลายเอ็น (N-terminus) ของ APP อยู่ติดกับแอมีลอยด์บีตา และหนึ่งในเอ็นไซม์ชนิดเดียวกันนี้ตัดออกจาก APP; N-APP กระตุ้นวิถีการทำลายตัวเองโดยการจับกับตัวรับของเซลล์ประสาทเรียก ตัวรับมรณะ 6 (DR 6 หรือ TNFRSF21); DR6 มีการแสดงออกสูงในบริเวณสมองของมนุษย์ที่ได้รับผลจากโรคอัลไซเมอร์มากที่สุด ฉะนั้นเป็นไปได้ที่วิถี N-APP/DR6 อาจถูกควบคุมในสมองวัยชราทำให้เกิดความเสียหาย ในแบบจำลองนี้ แอมีลอยด์บีตามีบทบาทส่งเสริมโดยการกดการทำหน้าที่ของจุดประสานประสาท
ต้นปี 2560 การทดลองเวอรูเบเซสแตด (verubecestat) ซึ่งยับยั้งโปรตีนบีตา-ซีครีเตส (beta-secretase) อันเป็นสาเหตุของการสร้างโปรตีนแอมีลอยด์บีตา ถูกระงับเนื่องจากคณะกรรมการอิสระพบว่า "แทบไม่มีโอกาสใด ๆ ในการค้นพบฤทธิ์ทางคลินิกเชิงบวก" ในปี 2561 และ 2562 การทดลองอื่น รวมทั้งอะดูแคนูแมบซึ่ลดความเข้มข้นของแอมีลอยด์บีตาล้มเหลว ทำให้บางคนตั้งคำถามว่าสมมติฐานแอมีลอยด์ยังสมเหตุสมผลอยู่หรือไม่
สมมติฐานเทา
สมมติฐานเทาเสนอว่าความผิดปกติของโปรตีนเป็นการเริ่มลำดับของโรค ในแบบจำลองนี้ เทาที่มีการเติมหมู่ฟอสเฟตมากเกิน (hyperphosphorylated tau) เริ่มจับคู่กับเทาสายอื่น จนสุดท้ายก่อเป็นนิวโรไฟบริลลารีแทงเกิล (neurofibrillary tangle) ภายในตัวเซลล์ประสาทไมโครทิวบูลจะสลายตัว เกิดการทำลายโครงสร้างไซโทสเกเลตอนของเซลล์แล้วทำให้ระบบขนส่งของเซลล์ประสาทไม่ทำงานด้วย การไม่ทำงานของระบบขนส่งนี้อาจทำให้การสื่อสารทางชีวเคมีระหว่างเซลล์ประสททำหน้าที่ผิดปกติก่อน แล้วทำให้เซลล์ตายตามมา
สมมติฐานอื่น
มีการเสนอสมมติฐานระบบประสาทและหลอดเลือดซึ่งระบุว่าอาจเกี่ยวข้องกับการทำหน้าที่อย่างเลวของตัวกั้นระหว่างเลือดกับสมอง นอกจากนี้ การติดเชื้อแบคทีเรียรูปเกลียว (spirochete) ยังมีความเชื่อมโยงกับภาวะสมองเสื่อม
ภาวะธำรงดุลของโลหะชีวภาพอย่างไอออนทองแดง เหล็กและสังกะสีใน AD เสียไป แม้ยังไม่ชัดเจนว่าภาวะดังกล่าวเป็นเหตุหรือผลของการเปลี่ยนแปลงโปรตีน ไอออนเหล่านี้ทั้งมีผลกระทบต่อและได้รับผลกระทบจากเทา APP และ APOE และการเสียการกำกับโปรตีนเหล่านี้อาจก่อให้เกิดความเครียดออกซิเจนซึ่งอาจส่งเสริมให้เกิดพยาธิสภาพ คุณภาพของการศึกษาเหล่านี้บางครั้งตกเป็นที่วิจารณ์ และความเชื่อมโยงนี้ยังเป็นที่ถกเถียงกันอยู่ นักวิจัยส่วนใหญ่ไม่สนับสนุนความสัมพันธ์เชิงเหตุผลกับอะลูมิเนียม
การสูบบุหรี่เป็นปัจจัยเสี่ยงที่สำคัญของ AD มาร์กเกอร์ทั่วกายสำหรับระบบภูมิคุ้มกันสืบทอดเป็นปัจจัยเสี่ยงของ AD ที่เกิดช้า มีหลักฐานเบื้อต้นว่าการสัมผัสกับมลภาวะทางอากาศอาจเป็นปัจจัยส่งเสริมต่อการเกิดโรคอัลไซเมอร์
สมมติฐานหนึ่งว่าการเสียหน้าที่ของโอลิโกเดนโดรไซต์และไมอีลีนที่สัมพันธ์กับพวกมันระหว่างการเปลี่ยนตามวัยเอื้อต่อความเสียหายต่อแกนประสาทนำเข้า ซึ่งจะทำให้เกิการผลิตแอมีลอยด์และการเติมหมู่ฟอสเฟตมากเกินของเทาเป็นผลข้างเคียง
รีโทรเจนะซิส (retrogenesis) เป็นสมมติฐานเกี่ยวกับการพัฒนาและการลุกลามของโรคอัลไซเมอร์ที่แบร์รี ไรซ์เบิร์ก (Barry Reisberg) เป็นผู้เสนอในคริสต์ทศวรรษ 1980 สมมติฐานคือขณะที่ทารกในครรภ์ผ่านกระบวนการเจริญของประสาทนิวรูเลชัน (neurulation) แล้วสิ้นสุดด้วยไมอีลินเนชัน (myelination) สมองของผู้ป่วย AD ผ่านกระบวนการเสื่อมของประสาทแบบย้อนกลับเริ่มต้นจากการสลายไมอีลีนและการตายของแกนประสาทนำเข้า (เนื้อขาว) จนสิ้นสุดด้วยการตายของเนื้อเทา สมมติฐานยังว่า ทารกผ่านขั้นพัฒนาการของการรู้ ผู้ป่วย AD ผ่านกระบวนการย้อนกลับการเสื่อมของการรู้แบบก้าวหน้า ไรซ์เบิร์กพัฒนาเครื่องมือการประเมินการดูแลที่เรียก "FAST" (เครื่องมือการจัดระยะการประเมินเชิงหน้าที่) ซึ่งเขาว่าทำให้ผู้ดูแลผู้ปว่ย AD สามารถบอกระยะการลุกลามของโรคและให้คำแนะนำเกี่ยวกับการดูแลชนิดที่จำเป็นในแต่ละระยะได้
พยาธิสรีรวิทยา
ประสาทพยาธิสภาพ
ลักษณะที่พบในโรคอัลไซเมอร์คือการสูญเสียเซลล์ประสาทและจุดประสานประสาทภายในเปลือกสมองและบริเวณใต้เปลือกสมอง ทำให้เกิดการฝ่อที่เห็นได้ของสมองบริเวณที่เป็นโรค ซึ่งรวมถึงการเสื่อมของสมองกลีบขมับ (temporal lobe) และสมองกลีบข้าง (parietal lobe) และส่วนหนึ่งของสมองกลีบหน้า (frontal cortex) และรอยนูนซิงกูเลต (cingulate gyrus) ของสมอง นอกจากนี้ยังปรากฏความเสื่อมในนิวเคลียสก้านสมอง เช่น โลคัสซีรูเลียส (locus coeruleus) การศึกษาโดยใช้เอ็มอาร์ไอและเพ็ตบันทึกการลดขนาดของสมองบางบริเวณในผู้ป่วยโรคอัลไซเมอร์เมื่อผู้ป่วยมีการลุกลามจากการบกพร่องของการู้เล็กน้อยจนถึงโรคอัลไซเมอร์ เมื่อเทียบกับภาพคล้ายกันจากผู้ใหญ่สูงอายุกว่าที่มีสุขภาพดี
พลากแอมีลอยด์และนิวโรไฟบริลลารีแทงเกิล (neurofibrillary tangle) เห็นได้ชัดเจนด้วยกล้องจุลทรรศน์ในสมองผู้ป่วยโรคอัลไซเมอร์ พลากมีลักษณะเป็นการสะสมของเพพไทด์แอมีลอยด์บีตาและสารองค์ประกอบของเซลล์ที่หนาแน่นและมักเป็นตะกอนอยู่ภายนอกและรอบ ๆ เซลล์ประสาท ส่วนนิวโรไฟบริลลารีแทงเกิลเกิดจากการรวมกลุ่มสะสมของโปรตีนที่เกี่ยวข้องกับไมโครทิวบูล ชื่อว่า โปรตีนเทา (tau protein) ซึ่งมีการเติมหมู่ฟอสเฟตมากผิดปกติ และสะสมอยู่ภายในเซลล์ประสาท แม้ว่าสมองของผู้สูงอายุหลายคนอาจพบพลากและแทงเกิลในสมองได้บ้างเนื่องจากความชราแต่สมองของผู้ป่วยโรคอัลไซเมอร์จะพบปริมาณคราบดังกล่าวมากกว่าในสมองบางบริเวณ เช่น บริเวณสมองกลีบขมับ ส่วนลิวอีบอดี (Lewy body) ก็พบได้ไม่น้อยในสมองผู้ป่วยโรคอัลไซเมอร์
ชีวเคมี
โรคอัลไซเมอร์จัดเป็นโรคโปรตีนม้วนพับผิดปกติ (protein misfolding disease) ที่เกิดจากการะสะสมพลากของโปรตีนแอมีลอยด์บีตาและโปรตีนเทาที่ม้วนพับผิดปกติในสมอง พลากเกิดจากเพปไทด์ขนาดเล็กยาวประมาณ 39–43 กรดอะมิโน ชื่อว่าแอมีลอยด์บีตา (Aβ) โดย Aβ เป็นชิ้นส่วนหนึ่งของโปรตีนสารตั้งต้นแอมีลอยด์ (APP) โปรตีนนี้เป็นทรานสเมมเบรนโปรตีน (transmembrane protein) ที่แทรกทะลุผ่านเยื่อหุ้มเซลล์ประสาท APP มีความจำเป็นต่อการเจริญเติบโต การดำรงชีวิต และการซ่อมแซมหลังได้รับบาดเจ็บของเซลล์ประสาท ในโรคอัลไซเมอร์ แกมมาซีครีเตสและบีตาซีครีเตสทำงานร่วมกันในกระบวนการการสลายโปรตีนซึ่งตัดแบ่ง APP ออกเป็นชิ้นส่วนเล็ก ๆ ชิ้นส่วนชิ้นหนึ่งที่เกิดขึ้นจะกลายเป็นเส้นใยแอมีลอยด์บีตา ซึ่งจับตัวเป็นก้อนตกตะกอนหนาแน่นอยู่นอกเซลล์ประสาท เรียกว่า ซีไนล์พลาก (senile plaque)
โรคอัลไซเมอร์ยังถือว่าเป็นความผิดปกติของโปรตีนเทา (tauopathy) เนื่องจากการสะสมโปรตีนเทาอย่างผิดปกติ เซลล์ประสาททุกเซลล์จะมีโครงร่างของเซลล์ (cytoskeleton) ซึ่งบางส่วนเกิดจากโครงสร้างที่เรียก ไมโครทิวบูล (microtubule) ไมโครทิวบูลนี้ทำหน้าที่เสมือนรางรถไฟคือเป็นเส้นทางลำเลียงสารอาหารและโมเลกุลจากตัวเซลล์ไปยังปลายแกนประสาทนำออก (axon) และนำกลับ โปรตีนที่ชื่อว่า เทา (tau; Τ) ทำหน้าที่ช่วยให้ไมโครทิวบูลเสถียรหลังเกิดปฏิกิริยาฟอสโฟรีเลชัน จึงเรียกโปรตีนเทาว่าเป็น โปรตีนที่สัมพันธ์กับไมโครทิวบูล (MAP) ในผู้ป่วยอัลไซเมอร์ โปรตีนเทาจะเกิดการเปลี่ยนแปลงทางเคมี คือมีปฏิกิริยาฟอสโฟรีเลชั่นมากกว่าปกติ ทำให้โปรตีนจับคู่กันเกิดเป็น นิวโรไฟบริลลารีแทงเกิล (neurofibrillary tangle) และรบกวนระบบการขนส่งของเซลล์ประสาท โปรตีนเทาที่มีพยาธิสภาพสามารถทำให้เซลล์ประสาทตายได้จากการเสียการกำกับแทรนส์โพเซเบิลเอลิมันต์ (transposable element)
กลไกการเกิดโรค
ยังไม่ทราบว่าการผลิตและการสะสมเพปไทด์แอมีลอยด์ทำให้เกิดพยาธิสภาพของโรคอัลไซเมอร์ได้อย่างไรแน่ชัด สมมติฐานแอมีลอยด์แต่เดิมชี้ว่าการสะสมเพปไทด์แอมีลอยด์เป็นเหตุการณ์ศูนย์กลางที่กระตุ้นให้เกิดความเสื่อมของเซลล์ประสาท การสะสมของกลุ่มเส้นใยแอมีลอยด์ซึ่งเชื่อว่าแอมิลอยด์แบบเป็นพิษที่ทำให้รบกวนภาวะธำรงดุลของไอออนแคลเซียมของเซลล์ ชักนำให้เกิดการตายของเซลล์ที่ตั้งโปรแกรมไว้หรืออะพอพโทซิส (apoptosis) นอกจากนี้ยังเป็นที่ทราบกันว่า Aβ เกิดขึ้นอย่างจำเพาะภายในไมโทคอนเดรียในเซลล์ที่เป็นโรคอัลไซเมอร์ ซึ่งไปยับยั้งการทำงานของเอนไซม์บางตัวและการใช้กลูโคสของเซลล์ประสาท
กระบวนการอักเสบและไซโตไคน์ต่าง ๆ อาจมีบทบาทในพยาธิสภาพของโรคอัลไซเมอร์ด้วย การอักเสบเป็นสารส่อทั่วไปของความเสียหายต่อเนื้อเยื่อในโรคต่าง ๆ และอาจเป็นผลจากความเสียหายต่อเนื้อเยื่อในโรคอัลไซเมอร์หรือเป็นสารส่อของการตอบสนองทางภูมิคุ้มกัน มีหลักฐานอันตรกิริยาอย่างเข้มระหว่างเซลล์ประสาทกับกลไกภูมิคุ้มกันในสมองเพิ่มขึ้น โรคอ้วนและการอักเสบทั่วร่างอาจรบกวนกระบวนการภูมิคุ้มกันซึ่งส่งเสริมการลุกลามของอัลไซเมอร์
นอกจากนี้ยังมีการอธิบายการเปลี่ยนแปลงการกระจายของแฟกเตอร์บำรุงสมองต่าง ๆ และการแสดงตัวรับของแฟกเตอร์เหล่านี้อย่าง brain-derived neurotrophic factor (BDNF) ในโรคอัลไซเมอร์ด้วย
การวินิจฉัย

การวินิจฉัยโรคอัลไซเมอร์อาศัยประวัติของผู้ป่วย ประวัติที่ได้จากญาติ และการสังเกตพฤติกรรม หากมีลักษณเฉพาะทางประสาทวิทยาและจิตประสาทวิทยาและคัดภาวะอื่นออกไปแล้วเป็นการสนับสนุนการวินิจฉัย การศึกษาจากภาพทางรังสีวิทยาเพิ่มเติมด้วยการถ่ายภาพรังสีส่วนตัดอาศัยคอมพิวเตอร์ (ซีที) หรือการสร้างภาพด้วยเรโซแนนซ์แม่เหล็ก (เอ็มอาร์ไอ) ร่วมกับเครื่องถ่ายภาพรังสีชนิดแกมมาหลายระนาบ (SPECT) หรือการถ่ายภาพรังสีระนาบด้วยการปล่อยโพซิตรอน (เพท) อาจช่วยในการคัดพยาธิสภาพทางสมองหรือชนิดย่อยของสมองเสื่อมอื่น ๆ ออกได้ ยิ่งไปกว่านั้น อาจช่วยพยากรณ์การเปลี่ยนจากขั้นบอกล่วงหน้าโรค (ความบกพร่องทางการรู้เล็กน้อย) เป็นโรคอัลไซเมอร์ได้
การประเมินสติปัญญา เช่น การทดสอบความจำสามารถจำแนกระยะของโรคอัลไซเมอร์ได้ มีหน่วยงานทางการแพทย์หลายสถาบันสร้างเกณฑ์การวินิจฉัยสำหรับแพทย์เพื่อให้การวินิจฉัยโรคอัลไซเมอร์ได้ง่ายและเป็นมาตรฐานมากขึ้น บางครั้งสามารถยืนยันการวินิจฉัยหลังผู้ป่วยเสียชีวิตได้อย่างแม่นยำจากการศึกษาชิ้นส่วนสมองด้วยวิธีการศึกษาเนื้อเยื่อด้วยกล้องจุลทรรศน์
เกณฑ์การวินิจฉัย
สถาบันโรคทางประสาทและการสื่อสารและโรคหลอดเลือดสมองแห่งชาติ (National Institute of Neurological and Communicative Disorders and Stroke) และสมาคมโรคอัลไซเมอร์ (Alzheimer's Association) ของสหรัฐสร้างเกณฑ์การวินิจฉัยโรคอัลไซเมอร์ที่เป็นที่นิยมใช้กันมากที่สุด คือ NINCDS-ADRDA Alzheimer's Criteria ในปี 2527 และมีการปรับปรุงอย่างกว้างขวางในปี 2550 เกณฑ์การวินิจฉัยดังกล่าวกำหนดให้ผู้ป่วยปรากฏความบกพร่องในการรู้และสงสัยเป็นกลุ่มอาการภาวะสมองเสื่อมต้องได้รับการตรวจยืนยันโดยการประเมินทางจิตประสาทวิทยาเพื่อวินิจฉัยทางคลินิกว่ามีโอกาส (possible) หรืออาจ (probable) เป็นโรคอัลไซเมอร์ ส่วนการวินิจฉัยแน่นอนได้แก่การตรวจยืนยันทางจุลพยาธิวิทยา คือการตรวจเนื้อเยื่อสมองทางจุลทรรศน์ พบว่าเกณฑ์การวินิจฉัยดังกล่าวมีความเชื่อถือได้และความสมเหตุสมผลดีเมื่อเทียบกับการวินิจฉัยยืนยันทางจุลพยาธิวิทยา ในผู้ป่วยโรคอัลไซเมอร์มักพบความบกพร่องของในการรู้ 8 รูปแบบ ได้แก่ ด้านความจำ, ภาษา, ทักษะด้านความรู้สึก, ความใส่ใจ, ทักษะกล้ามเนื้อ, การรู้กาลเทศะและบุคคล, การแก้ปัญหา และความสามารถเชิงหน้าที่ รูปแบบการรู้ที่บกพร่องดังกล่าวเทียบเท่ากับเกณฑ์การวินิจฉัย NINCDS-ADRDA Alzheimer's Criteria ดังที่ระบุในเกณฑ์การวินิจฉัยโรคทางจิตเวช คู่มือการวินิจฉัยและสถิติสำหรับความผิดปกติทางจิต (DSM-IV-TR) ซึ่งตีพิมพ์โดยสมาคมจิตเวชศาสตร์อเมริกา
เครื่องมือในการวินิจฉัย
มีการใช้การทดสอบทางจิตประสาทวิทยาต่าง ๆ เช่น การตรวจสุขภาวะทางจิตแบบย่อ (mini-mental state examination; MMSE) อย่างกว้างขวางเพื่อประเมินความบกพร่องในการรู้เพื่อใช้วินิจฉัยโรค ส่วนชุดแบบทดสอบที่ละเอียดและครอบคลุมกว่านี้มีความจำเป็นสำหรับผลลัพธ์ที่มีความน่าเชื่อถือสูง โดยเฉพะาอย่างยิ่งในระยะแรก ๆ ของโรคอัลไซเมอร์การตรวจทางประสาทวิทยาในผู้ป่วยโรคอัลไซเมอร์ระยะแรกโดยทั่วไปให้ผลปกติ ยกเว้นสำหรับการรู้เสื่อมอย่างชัดเจนเท่านั้น ซึ่งไม่ได้ต่างจากผลที่เกิดจากกระบวนการของโรคอื่น รวมทั้งภาวะความจำเสื่อมจากสาเหตุอื่น
การตรวจทางประสาทวิทยาเพิ่มเติมมีความสำคัญในการวินิจฉัยแยกโรคโรคอัลไซเมอร์และโรคอื่น ๆ การซักประวัติจากสมาชิกในครอบครัวอาจช่วยในการประเมินโรค ผู้ดูแลผู้ป่วยอาจให้ข้อมูลที่สำคัญเกี่ยวกับความสามารถในการประกอบกิจวัตรชีวิตประจำวันของผู้ป่วย รวมทั้งความถดถอยของหน้าที่ทางจิตของผู้ป่วยตามเวลา ความเห็นหรือมุมมองของผู้ดูแลมักมีความสำคัญในการวินิจฉัยหากผู้ป่วยโรคอัลไซเมอร์นั้นปกติไม่รับรู้ความเจ็บป่วยของตนเอง หลายครั้งครอบครัวอาจพบอาการของภาวะสมองเสื่อมระยะแรกได้ยากตั้งแต่แรกและอาจสื่อสารข้อมูลที่ไม่ถูกต้องแม่นยำแก่แพทย์
การทดสอบเพิ่มเติมให้ข้อมูลเพิ่มในบางลักษณะของโรคหรือใช้เพื่อคัดการวินิจฉัยอื่นออก การตรวจเลือดสามารถช่วยระบุสาเหตุอื่นของภาวะความจำเสื่อมที่ไม่ใช่โรคอัลไซเมอร์ได้ ซึ่งสาเหตุเหล่านี้มักพบได้น้อยแต่หายขาดได้ แพทย์ปกติตรวจการทำงานของไทรอยด์ ประเมินระดับวิตามินบี12 แยกโรคซิฟิลิส แยกปัญหาเมแทบอลิก (รวมทั้งการทดสอบการทำงานของไต ระดับอิเล็กโทรไลต์ และโรคเบาหวาน) ประเมินระดับโลหะหนัก (เช่น ตะกั่ว ปรอท) และภาวะโลหิตจาง และอาจจำเป็นต้องแยกอาการเพ้อ
การทดสอบทางจิตวิทยาสำหรับโรคซึมเศร้าอาจช่วยในการวินิจฉัยเพราะโรคซึมเศร้าสามารถเกิดร่วมกับโรคอัลไซเมอร์ หรือเป็นสาเหตุของความบกพร่องในการรู้
ไม่แนะนำให้ใช้ C-PIB-PET สแกนเป็นเครื่องมือวินิจฉัยระยะแรกหรือใช้พยากรณ์การพัฒนาโรคอัลไซเมอร์เมื่อบุคคลปรากฏอาการแสดงของความบกพร่องทางการรู้เล็กน้อย (MCI) เพราะมีความแม่นยำต่ำ หลักฐานไม่รองรับการใช้ ¹⁸F-FDG PET สแกนเป็นการทดสอบเดี่ยว ๆ เพื่อใช้ระบุบุคคลที่อาจเป็นโรคอัลไซเมอร์เช่นกัน
การป้องกัน

ไม่มีหลักฐานชี้ชัดสนับสนุนว่ามีวิธีหนึ่งวิธีใดที่สามารถป้องกันโรคอัลไซเมอร์ได้อย่างมีผล การศึกษาทั่วโลกว่าด้วยมาตรการป้องกันหรือชะลอการเกิดโรคอัลไซเมอร์มักให้ผลขัดแย้งกัน การศึกษาทางวิทยาการระบาดเสนอว่ามีความสัมพันธ์ระหว่างปัจจัยที่สามารถแก้ไขได้อย่างอย่าง เช่น อาหาร ความเสี่ยงของโรคหัวใจและหลอดเลือด ผลิตภัณฑ์เภสัชกรรม หรือกิจกรรมทางสติปัญญา เป็นต้น กับโอกาสเกิดโรคอัลไซเมอร์ในประชากร แต่ยังต้องมีการวิจัยตลอดจนการทดลองทางคลินิกเพิ่มเติมเพื่อหาคำตอบว่าปัจจัยเหล่านี้สามารถช่วยลดโรคอัลไซเมอร์ได้หรือไม่
อาหาร
บุคคลที่รับประทานอาหารสุขภาพดี หรืออาหารญี่ปุ่น หรืออาหารเมดิเตอร์เรเนียนมีควมเสี่ยงเกิดโรคอัลไซเมอร์ลดลง อาหารเมดิเตอร์เรเนียนอาจช่วยปรับปรุงผลลัพธ์ของผู้ป่วยได้ ส่วนุคลที่รับประทานอาหารที่มีไขมันอิ่มตัวสูงและคาร์โบไฮเดรตอย่างง่าย (มอโนหรือไดแซ็กคาไรด์) มีความเสี่ยงสูงกว่า มีการเสนอว่าประโยชน์ต่อระบบหัวใจและหลอดเลือดของอาหารเมดิเตอร์เรเนียนเป็นกลไกการออกฤทธิ์ลดโรคอัลไซเมอร์
บางทีข้อสรุปต่อส่วนประกอบอาหารทำให้แน่ใจได้ยากเพราะผลแตกต่างกันระหว่างการศึกษาจากประชากรกับการทดลองแบบสุ่มที่มีการควบคุม มีหลักานจำกัดว่าการใช้แอลกอฮอล์ปริมาณน้อยถึงปานกลาง โดยเฉพาะอย่างยิ่งไวน์แดง มีความสัมพันธ์กับความเสี่ยงต่อโรคอัลไซเมอร์ที่ลดลง มีหลักฐานเบื้องต้นว่าคาเฟอีนอาจช่วยป้องกัน อาหารที่มีฟลาโวนอยด์สูงจำนวนหนึ่ง เช่น โกโก้ ไวน์แดงและชา อาจลดความเสี่ยงของโรคอัลไซเมอร์
บทปฏิทัศน์เรื่องการใช้วิตามินและเกลือแร่ไม่พบว่ามีหลักฐานสอดคล้องกันในการแนะนำให้รับประทานวิตามินและเกลือแร่ ซึ่งรวมทั้งวิตามินเอ ซี รูปแอลฟาโทโคฟีรอลของวิตามินอีเซเลเนียมสังกะสี และกรดโฟลิกทั้งที่มีหรือไม่มีวิตามินบี12 หลักฐานจากการศึกษาแบบสุ่มที่มีการควบคุมครั้งหนึ่งบ่งชี้ว่ารูปแอลฟาโทโคฟีรอลของวิตามินอีอาจชะลอการเสื่อมของการรู้ แต่มีการตัดสินว่าหลักฐานนี้มีคุณภาพ "ปานกลาง" การทดลองที่พิจารณากรดโฟลิก (บี9) กับวิตามินบีอื่นไม่พบความสัมพันธ์อย่างมีนัยสำคัญกับการเสื่อมของการรู้ใด ๆ อาหารเสริมกรดไขมันโอเมกา-3 จากพืชแสัตว์ และกรดโดโคซาเฮ็กซาอีโนอิก (DHA) ไม่ปรากฏว่ามีประโยชน์ในโรคอัลไซเมอร์ระดับอ่อนถึงปานกลาง
สารเคอร์คิวมิน (curcumin) จากขมิ้นไม่พบประโยชน์ในมนุษย์แม้มีหลักฐานเบื้องต้นในสัตว์ ไม่มีหลักฐานสอดล้องกันและน่าเชื่อได้ว่าแปะก๊วยมีผลดีในการป้องกันความบกพร่องของการรู้และภาวะสมองเสื่อม จนถึงปี 2551 ไม่มีหลักฐานรูปธรรมว่าแคนนาบินอยด์ (cannabinoids) มีผลช่วยลดอาการของโรคอัลไซเมอร์หรือภาวะสมองเสื่อม อย่างไรก็ดี การวิจัยบางส่วนต่อเอ็นโดแคนนาบินอยด์ (endocannabinoids) ดูมีหวัง
ยา
แม้ว่าปัจจัยเสี่ยงด้านโรคหลอดเลือดหัวใจ เช่น ภาวะเลือดมีคอเลสเทอรอลมาก ความดันโลหิตสูง เบาหวาน และการสูบบุหรี่ จะเกี่ยวข้องกับโอกาสเสี่ยงเกิดที่สูงขึ้นและระยะเวลาการดำเนินโรคอัลไซเมอร์ แต่การใช้ยากลุ่มสแตตินซึ่งเป็นยาลดคอเลสเทอรอลไม่มีประสิทธิผลในการป้องกันหรือช่วยทำให้การดำเนินโรคอัลไซเมอร์ดีขึ้น
ในปี 2550 คาดกันว่าการใช้ยากลุ่มยาแก้อักเสบชนิดไม่ใช่สเตรอยด์ (NSAIDs) เช่น แอสไพริน ไอบูโปรเฟน ในระยะยาวช่วยลดโอกาสเกิดโรคอัลไซเมอร์ได้บ้าง หลักฐานเสนอว่า NSAIDs อาจลดการอักเสบที่เกี่ยวข้องกับแอมีลอยด์พลาก แต่การทดลองถูกระงับเพราะมีผลเสียสูง ไม่มีการทดลองเพื่อป้องกันโรคใดสำเร็จเลย จนถึงปี 2554 มีการเสนอยาบางชนิดเป็นสารป้องกันก่อนเกิดอาการ แต่ดูมีประโยชน์ไม่เท่ากับการรักษาฮอร์โมนทดแทนในสตรีหมดประจำเดือนซึ่งเคยใช้กันแต่เดิม อาจเพิ่มความเสี่ยงภาวะสมองเสื่อมด้วยซ้ำ
วิถีชีวิต
บุคคลที่ดำเนินกิจกรรมที่ต้องใช้ทักษะทางสติปัญญาเช่นอ่านหนังสือ เล่นหมากกระดาน เล่นปริศนาอักษรไขว้ เล่นดนตรี หรือมีปฏิสัมพันธ์ทางสังคมเป็นประจำมีความเสี่ยงการเกิดโรคอัลไซเมอร์ลดลง ซึ่งสอดคล้องกับทฤษฎีการสงวนการรู้ (cognitive reserve theory) ที่ระบุว่า ประสบการณ์ชีวิตบางอย่างส่งผลให้การทำหน้าที่ของประสาทมีประสิทธิภาพมากยิ่งขึ้นทำให้ปัจเจกบุคคลมีการสงวนการรู้ซึ่งชะลอการเกิดอาการแสดงของภาวะสมองเสื่อม การศึกษาชะลอการเกิดกลุ่มอาการโรคอัลไซเมอร์แต่ไม่เปลี่ยนระยะเวลาของโรค การเรียนภาษาที่สองแม้มีอายุมากแล้วดูเหมือนช่วยชะลอการเกิดโรคอัลไซเมอร์ กิจกรรมทางกายก็มีความสัมพันธ์กับโอกาสการเกิดโรคอัลไซเมอร์ลดลงเช่นกัน การออกกำลังกายสัมพันธ์กับอัตราภาวะสมองเสื่อมที่ลดลง และยังมีประสิทธิภาพในการลดความรุนแรงของอาการในผู้ป่วยโรคอัลไซเมอร์
การบำบัดและการจัดการ
ปัจจุบันยังไม่มีการรักษาโรคอัลไซเมอร์ให้หาย การรักษาที่มีในปัจจุบันให้ผลดีเล็กน้อยต่ออาการแต่โดยสภาพแล้วเป็นเพื่อการประทังเท่านั้น การรักษาในปัจจุบันแบ่งออกเป็น 3 รูปแบบ คือ การรักษาด้วยยา การรักษาทางจิตสังคม และการให้การดูแลผู้ป่วย
การรักษาด้วยยา


ปัจจุบันมียาหรือเภสัชภัณฑ์ 5 ชนิดที่ใช้เพื่อรักษาอาการทางการรับรู้ในโรคอัลไซเมอร์ ประกอบด้วย 4 ชนิดเป็นแอนติโคลีนเอสเทอเรส (anticholinesterase) คือ tacrine, rivastigmine, galantamine และ donepezil และอีก 1 ชนิด คือเมแมนทีน (memantine) ซึ่งเป็นสารต้านตัวรับเอ็นเอ็มดีเอ (NMDA receptor antagonist) ประโยชน์ของการใช้ยาเหล่านี้มีน้อย ไม่มียาใดที่แสดงให้เห็นชัดเจนว่าชะลอหรือหยุดการดำเนินโรคอย่างแท้จริง
ลักษณะของโรคอัลไซเมอร์ที่เป็นทราบกันดี คือ กัมมันตภาพของเซลล์ประสาทโคลิเนอร์จิก (cholinergic) มีลดลง มีการใช้แอนติโคลีนเอสเทอเรสเพื่อลดอัตราการสลายแอซิทิลโคลีน (acetylcholine; ACh) ทำให้เพิ่มปริมาณความเข้มข้นของ ACh ในสมองเพื่อชดเชย ACh ที่มีปริมาณลดลงอันเนื่องจากการตายของเซลล์ประสาทโคลิเนอร์จิก มีหลักฐานประสิทธิผลของยาเหล่านี้ในโรคอัลไซเมอร์ขั้นเบาถึงปานกลาง และมีหลักฐานบ้างสำหรับการใช้ในระยะรุนแรง การใช้ยาเหล่านี้ในความบกพร่องทางการรู้เล็กน้อยไม่แสดงว่ามีผลชะลอการเกิดโรคอัลไซเมอร์แม้แต่น้อยผลข้างเคียงที่พบบ่อยที่สุด ได้แก่ คลื่นไส้อาเจียน ซึ่งอาการทั้งสองเชื่อมโยงกับปริมาณโคลิเนอร์จิกที่มากเกิน ผลข้างเคียงเหล่านี้พบได้ในประมาณ 10–20% ของผู้ใช้ยา และมีความรุนแรงระดับเบาถึงปานกลาง และสามารถจัดการได้โดยปรับขนาดยาช้า ๆ ผลที่พบน้อยลงมา เช่น ตะคริว หัวใจเต้นช้า เบื่ออาหาร น้ำหนักลด และเพิ่มการสร้างกรดกระเพาะ
กลูตาเมตเป็นสารสื่อประสาทชนิดกระตุ้นในระบบประสาท แต่หากมีปริมาณมากเกินในสมองอาจทำให้เซลล์ตายได้จากกระบวนการชื่อว่า ภาวะเอ็กไซโททอกซิก (excitotoxicity) อันเกิดจากการกระตุ้นอย่างมากเกินของตัวรับกลูตาเมต ภาวะเอ็กไซโททอกซิกไม่ได้เกิดเฉพาะในโรคอัลไซเมอร์ แต่ยังพบในโรคทางระบบประสาทอื่น เช่น โรคพาร์กินสันและโรคปลอกประสาทเสื่อมแข็ง (multiple sclerosis)เมแมนทีน (Memantine) เป็นสารต้านตัวรับเอ็นเอ็มดีเอชนิดไม่แข่งขัน (noncompetitive) ซึ่งใช้ครั้งแรกเป็นสารต้านไข้หวัดใหญ่ สารนี้จะทำงานในระบบกลูตาเมเทอร์จิกโดยขัดขวางตัวรับเอ็นเอ็มดีเอและยับยั้งการกระตุ้นมากเกินของกลูตาเมต เมแมนทีนมีประสิทธิภาพเล็กน้อยในการรักษาโรคอัลไซเมอร์ชนิดปานกลางและรุนแรง ผลข้างเคียงของเมแมนทีนยังรายงานพบไม่บ่อยและไม่รุนแรง เช่น ประสาทหลอน สับสน เวียนศีรษะ ปวดศีรษะ และล้า การใช้ยาเมแมนทีนและโดเนเพซิลร่วมกันให้ประสิทธิผลอย่างมีนัยสำคัญทางสถิติ แต่มีประสิทธิผลเพียงเล็กน้อยในทางคลินิก
ยารักษาโรคจิตนอกแบบ (atypical antipsychotics) มีประโยชน์ในการลดความก้าวร้าวและโรคจิตในผู้ป่วยโรคอัลไซเมอร์อยู่บ้าง แต่ประโยชน์นั้นอาจมีน้อยกว่าผลข้างเคียงที่รุนแรง เช่น โรคหลอดเลือดสมอง ปัญหาการเคลื่อนไหวหรือการรู้ลดลง และการใช้ระยะยาวมีการแสดงว่าสัมพันธ์กับอัตราตายที่เพิ่มขึ้น การหยุดใช้ยาต้านโรคจิตในผู้ป่วยโรคอัลไซเมอร์ดูปลอดภัย
แม้ว่ายาฮูเปอร์ซีนเอ (Huperzine A) จะดูมีหวัง แต่ยังต้องมีหลักฐานเพิ่มเติมก่อนแนะนำให้ใช้
การรักษาทางจิตสังคม

มีการนำการรักษาทางจิตสังคมมาใช้เสริมกับการรักษาด้วยยา แบ่งออกเป็นวิธีมุ่งเน้นด้านพฤติกรรม (behaviour-oriented), อารมณ์ (emotion-oriented), การรู้ (cognition-oriented) หรือการกระตุ้น (stimulation-oriented) ส่วนงานวิจัยว่าด้วยประสิทธิผลนั้นยังหาไม่พบและไม่จำเพาะต่อโรคอัลไซเมอร์ แต่มุ่งเน้นไปยังภาวะสมองเสื่อมโดยรวมแทน
การแก้ไขพฤติกรรมคือการพยายามระบุและลดสิ่งที่เกิดขึ้นก่อนและผลที่ตามมาของพฤติกรรมปัญหา วิธีดังกล่าวยังไม่แสดงผลสำเร็จในการทำให้หน้าที่โดยรวมดีขึ้น แต่สามารถช่วยลดปัญหาพฤติกรรมบางอย่างได้ เช่น การกลั้นปัสสาวะไม่ได้ ปัจจุบันยังขาดข้อมูลคุณภาพสูงเกี่ยวกับประสิทธิผลของเทคนิคดังกล่าวในการรักษาปัญหาพฤติกรรมอื่น ๆ เช่น การหนีออกจากบ้าน ดนตรีบำบัดมีประสิทธิภาพลดอาการทางพฤติกรรมและจิต
การรักษาที่มุ่งเน้นด้านอารมณ์ได้แก่ การบำบัดด้วยความทรงจำ (reminiscence therapy; RT), การบำบัดด้วยการให้เหตุผล (validation therapy), จิตบำบัดแบบประคับประคอง (supportive psychotherapy), การบูรณาการการรับความรู้สึก (sensory integration) หรือที่เรียกว่า สโนซีเลน (snoezelen) และการบำบัดด้วยการจำลองการมีอยู่ (simulated presence therapy; SPT) บทปฏิทัศน์คอคแครนไม่พบหลักฐานว่าการรักษาดังกล่าวมีประสิทธิภาพ จิตบำบัดแบบประคับประคองมีการศึกษาทางวิทยาศาสตร์รูปนัยน้อยหรือไม่มีเลย แต่แพทย์บางคนพบว่าวิธีดังกล่าวช่วยให้บุคคลที่มีการรู้บกพร่องเล็กน้อยปรับตัวเข้ากับความเจ็บป่วยของตนได้ การบำบัดด้วยความทรงจำเกี่ยวข้องกับการอภิปรายประสบการณ์ในอดีตเป็นกลุ่มหรือแยกเดี่ยว ซึ่งมีการใช้ภาพถ่าย สิ่งของในบ้าน บันทึกดนตรีและเสียง หรือสิ่งของที่คุ้นเคยอย่างอื่นในอดีตมาช่วย บทปฏิทัศน์ปี 2561 ของ RT พบว่าผลลัพธ์ไม่เป็นไปในทิศทางเดียวกัน การทดลองมีขนาดเล็กและนัยสำคัญทางคลินิกที่น่าสงสัย และมีสถานที่แตกต่างกัน การบำบัดด้วยการจำลองการมีอยู่ตั้งอยู่บนทฤษฎีการยึดติด (attachment) และมีการเล่นบันทึกเสียงของญาติสนิทที่สุดของผู้ป่วยโรคอัลไซเมอร์ มีหลักฐานบ้างว่า SPT อาจลดพฤติกรรมท้าทาย ท้ายที่สุด การบำบัดด้วยการให้เหตุผลอาศัยพื้นฐานของการยอมรับความเป็นจริงและความจริงส่วนบุคคลของประสบการณ์ผู้อื่น ต่างจากการบูรณาการการรับความรู้สึก (sensory integration) ที่อาศัยการออกกำลังกายเพื่อกระตุ้นประสาทสัมผัสเป็นพื้นฐาน ทั้งนี้ ไม่มีหลักฐานสนับสนุนประโยชน์ของการบำบัดสองวิธีนี้
เป้าหมายของการรักษาที่มุ่งเน้นการรู้คือการลดความบกพร่องในการรู้ (cognitive deficit) ซึ่งได้แก่การรับรู้ความเป็นจริงและการฟื้นฟูการรู้ การรับรู้ความเป็นจริง (reality orientation) ประกอบด้วยการรับรู้ข้อมูลเกี่ยวกับเวลา สถานที่ หรือบุคคลเพื่อช่วยให้เข้าใจตัวตนเกี่ยวกับสภาวะแวดล้อมและสถานที่ที่เขาอยู่ ในขณะที่การฟื้นฟูการรู้ (cognitive retraining) มุ่งพัฒนาความสามารถที่บกพร่องโดยการบริหารจิต ทั้งสองวิธีการแสดงประสิทธิผลบางส่วนในการทำให้ความสามารถด้านการรู้ดีขึ้น แม้ในบางการศึกษาผลดังกล่าวเกิดขึ้นเพียงชั่วคราวและมีรายงานว่าเกิดผลเสียต่อผู้ป่วย เช่น ความคับข้องใจ
การรักษาที่มุ่งเน้นการกระตุ้น เช่น ศิลปะบำบัด ดนตรีบำบัด การบำบัดโดยอาศัยสัตว์เลี้ยง กายภาพบำบัด และนันทนาการบำบัดชนิดอื่น การกระตุ้นมีการสนับสนุนอยู่บ้างเพื่อพัฒนาพฤติกรรม อารมณ์ และหน้าที่ อย่างไรก็ตาม การรักษาเหล่านี้นอกจากจะให้ผลดีในด้านการรักษาแล้วประโยชน์หลักยังช่วยพัฒนาทักษะในชีวิตประจำวันด้วย ประสิทธิผลของการกระตุ้นสมองที่ไม่รุกล้ำและการกระตุ้นสมองแบบรุกล้ำในผู้ป่วยโรคอัลไซเมอร์ยังไม่แน่ชัด
การดูแลผู้ป่วย
เหตุที่โรคอัลไซเมอร์ยังไม่สามารถรักษาหายขาดได้ และผู้ป่วยไม่สามารถตอบสนองความต้องการของตัวเองมากขึ้นเรื่อย ๆ ผู้ดูแลจึงมีความสำคัญในการรักษาและต้องช่วยจัดการดูแลอย่างระมัดระวังตลอดการดำเนินโรค
ในผู้ป่วยระยะแรกและระยะปานกลาง การปรับเปลี่ยนสิ่งแวดล้อมที่อยู่อาศัยและวิถีชีวิตช่วยให้ผู้ป่วยมีความปลอดภัยมากขึ้นและลดภาระต่อผู้ดูแลได้ ตัวอย่างเช่นการปรับเปลี่ยนสภาพแวดล้อมให้ผู้ป่วยใช้ชีวิตประจำวันง่ายขึ้น การล็อกบ้านและรั้ว การติดป้ายหรือฉลากบนเครื่องใช้ภายในบ้านเพื่อบอกหรือเตือนผู้ป่วย หรือการใช้อุปกรณ์ชีวิตประจำวันที่มีการดัดแปลง ถ้าผู้ป่วยเริ่มมีปัญหาการรับประทาน อาจเตรียมอาหารเป็นชิ้นเล็ก ๆ หรือปั่น ถ้าผู้ป่วยเริ่มมีอาการกลืนลำบากอาจต้องใช้สายให้อาหาร (feeding tube) ในกรณีดังกล่าวผู้ดูแลและสมาชิกในครอบครัวควรคำนึงถึงประสิทธิผลและจริยธรรมของการให้อาหารทางสายยางต่อเนื่อง ไม่มีข้อบ่งชี้ให้ทำการยึดยั้งผู้ป่วยอยู่กับที่ในทุกระยะของโรค แต่มีบางสถานการณ์จำเป็นต้องใช้วิธีดังกล่าวเพื่อป้องกันไม่ให้ผู้ป่วยเกิดอันตรายหรือทำอันตรายต่อผู้ดูแล
เมื่อโรคดำเนินไป อาจเกิดปัญหาทางการแพทย์อื่น ๆ ตามมา เช่น โรคในช่องปากและฟัน แผลกดทับ ขาดสารอาหาร ปัญหาสุขอนามัย หรือการติดเชื้อในทางเดินหายใจ ผิวหนังหรือตา การดูแลอย่างระมัดระวังช่วยป้องกันภาวะดังกล่าว และหากเกิดปัญหาดังกล่าวตามมาแล้วต้องรับการรักษาโดยผู้เชี่ยวชาญ ในระยะสุดท้ายของโรค การรักษาจะมุ่งเน้นการบรรเทาความรู้สึกไม่สะดวกสบายไปจนกระทั่งผู้ป่วยเสียชีวิต โดยมักอาศัยความช่วยเหลือของฮอสพิส (hospice)
การพยากรณ์โรค

การวินิจฉัยโรคอัลไซเมอร์ในระยะแรกทำได้ยาก การวินิจฉัยแน่นอนมักต้องปรากฏความบกพร่องในการรู้ที่เป็นอันตรายต่อกิจวัตรประจำวันแม้ว่าผู้ป่วยจะยังสามารถอยู่โดยไม่พึ่งพาผู้อื่นได้ โรคจะดำเนินต่อไปจากปัญหาการรู้เล็กน้อยเช่นความจำเสื่อม ไปเป็นระยะที่รบกวนการรู้และอื่น ๆ จนไม่อาจดำรงชีวิตอยู่ด้วยตัวเองได้ โดยเฉพาะในระยะท้ายของโรค
ผู้ป่วยโรคอัลไซเมอร์มีการคาดหมายคงชีพน้อยกว่าประชากรปกติ อายุคาดหมายคงชีพหลังวินิจฉัยตรงแบบมีพิสัยระหว่าง 3 ถึง 10 ปี ผู้ป่วยน้อยกว่า 3% ดำรงชีวิตอยู่เกิน 14 ปีหลังได้รับการวินิจฉัย ลักษณะที่สำคัญของโรคนี้อันสัมพันธ์กับอัตรารอดชีพที่ลดลง คือ การเพิ่มความรุนแรงของความบกพร่องทางการรู้, การลดระดับการทำหน้าที่, ประวัติการล้ม, และการรบกวนการทดสอบทางประสาทวิทยา โรคอื่น ๆ ที่อาจเกิดร่วม เช่น โรคหัวใจ เบาหวาน หรือประวัติการติดสุราก็เกี่ยวข้องกับการรอดชีพที่ลดลง แม้ว่าผู้ป่วยยิ่งเกิดโรคอัลไซเมอร์เร็วเท่าใดก็ยิ่งมีปีรอดชีพรวมนานขึ้น แต่การคาดหมายคงชีพจะลดลงเป็นพิเศษเมื่อเทียบกับประชากรสุขภาพดีในกลุ่มที่มีอายุน้อย ชายมีแนวโน้มพยากรณ์รอดชีพน้อยกว่าหญิง
ปอดบวมและภาวะขาดน้ำเป็นสาเหตุสุดท้ายของการตายที่พบบ่อยที่สุด ส่วนมะเร็งเป็นสาเหตุการเสียชีวิตที่พบน้อยกว่าประชากรทั่วไป
วิทยาการระบาด
| อายุ | ผู้ป่วยใหม่ต่อ พันคน–ปี |
|---|---|
| 65–69 | 3 |
| 70–74 | 6 |
| 75–79 | 9 |
| 80–84 | 23 |
| 85–89 | 40 |
| 90– | 69 |
การศึกษาทางวิทยาการระบาดอาศัยการวัดหลัก 2 ชนิด คือ อุบัติการณ์และความชุกของโรค อุบัติการณ์คือจำนวนผู้ป่วยรายใหม่ต่อหน่วยคน–เวลาที่เสี่ยงรับโรค (มักใช้จำนวนผู้ป่วยใหม่ต่อพันคน–ปี) ในขณะที่ความชุกของโรคคือจำนวนผู้ป่วยทั้งหมดที่เป็นโรคในประชากรทั้งหมดในเวลาหนึ่ง
เมื่อพิจารณาอุบัติการณ์ การศึกษาตามแผน (cohort study) ติดตามประชากรที่ยังไม่มีโรคอัลไซเมอร์ในระยะเวลาหลายปี พบว่ามีอัตราเกิดภาวะสมองเสื่อมระหว่าง 10–15 ต่อพันคน–ปี และอัตราเป็นโรคอัลไซเมอร์ 5–8 ต่อพันคน–ปี ซึ่งหมายความว่าในจำนวนผู้ป่วยสมองเสื่อมใหม่ในแต่ละปีมีครึ่งหนึ่งเป็นโรคอัลไซเมอร์ การมีอายุมากขึ้นเป็นปัจจัยเสี่ยงหลักของโรคนี้ และอัตราอุบัติการณ์โรคในแต่ละช่วงวัยก็ไม่เท่ากันกล่าวคือหลังจากอายุ 65 ปีขึ้นไป ทุกๆ 5 ปีหลังจากนั้นความเสี่ยงที่จะเกิดโรคอัลไซเมอร์จะเพิ่มขึ้นเป็นสองเท่า คือเพิ่มตั้งแต่ 3 จนถึง 69 ต่อพันคน–ปี นอกจากนี้อัตราอุบัติการณ์ยังแตกต่างกันระหว่างเพศ เพศหญิงจะมีความเสี่ยงมากกว่าที่จะเป็นโรคอัลไซเมอร์โดยเฉพาะอย่างยิ่งในประชากรที่มีอายุมากกว่า 85 ปี ในสหรัฐ ความเสี่ยงการเสียชีวิตจากโรคอัลไซเมอร์ในประชากรขาวที่มิใช่ฮิสแปนิกสูงกว่าประชากรดำที่มิใช่ฮิสแปนิก 26% ขณะที่ประชากรฮิสแปนิกมีความเสี่ยงต่ำกว่าประชากรขาวที่มิใช่ฮิสแปนิก 30%
ความชุกของโรคอัลไซเมอร์ในประชากรขึ้นกับปัจจัยต่าง ๆ เช่น อุบัติการณ์และอัตรารอด เนื่องจากอุบัติการณ์ของโรคอัลไซเมอร์เพิ่มขึ้นตามอายุ การวิเคราะห์จึงจำเป็นต้องอาศัยอายุเฉลี่ยของประชากรที่สนใจด้วย มีการประมาณความชุกของโรคอัลไซเมอร์ในสหรัฐที่ประมาณ 1.6% ในปี 2543 ทั้งในประชากรทั้งหมดและในกลุ่มอายุ 65–74 ปี และมีอัตราเพิ่มขึ้นเป็น 19% ในกลุ่มอายุ 75–84 ปี และ 42% ในกลุ่มอายุมากกว่า 84 ปี อัตราความชุกในประเทศกำลังพัฒนาน้อยกว่าในประเทศพัฒนาแล้วองค์การอนามัยโลกประมาณว่าในปี 2548 ประชากรทั่วโลก 0.379% มีภาวะสมองเสื่อม และอุบัติการณ์จะเพิ่มขึ้นเป็น 0.441% ในปี 2558 และเป็น 0.556% ในปี 2573 การศึกษาอื่นๆ ก็ให้ข้อสรุปที่ใกล้เคียงกัน การสึกษาอื่นให้ข้อสรุปคล้ายกัน ในการศึกษาครั้งหนึ่งประมาณว่าในปี 2549 ประชากรโลก 0.40% (พิสัย 0.17–0.89%; จำนวนสัมบูรณ์ 26.6 ล้านคน; พิสัย 11.4–59.4 ล้านคน) ป่วยเป็นโรคอัลไซเมอร์ และอัตราความชุกจะเพิ่มเป็น 3 เท่า และจำนวนสัมบูรณ์จะเพิ่มเป็น 4 เท่าในปี 2593
ประวัติศาสตร์
นักปรัชญาและแพทย์ในยุคกรีกโบราณและโรมันเชื่อมโยงวัยสูงอายุกับภาวะสมองเสื่อมที่เพิ่มขึ้น แต่ย่างเข้าปี 2444 กว่าที่จิตแพทย์ชาวเยอรมันชื่อ อาลอยซ์ อัลซไฮเมอร์ (Alois Alzheimer) สามารถระบุผู้ป่วยคนแรกด้วยโรคที่ต่อมาได้ชื่อว่า โรคอัลไซเมอร์ ในผู้ป่วยหญิงอายุ 55 ปีชื่อ ออกุสต์ เด. เขาติดตามผู้ป่วยรายนี้จนเสียชีวิตในปี 2449 และได้รายงานต่อสาธารณชนเป็นครั้งแรกในปีนั้น จากนั้นเป็นเวลา 5 ปี มีรายงานผู้ป่วยที่มีอาการเดียวกัน 11 รายในเอกสารทางการแพทย์ รายงานบางส่วนเริ่มใช้คำว่า "โรคอัลไซเมอร์" แล้ว เอมิล เครเพลิน (Emil Kraepelin) อธิบายโรคนี้เป็นโรคใหม่เป็นครั้งแรกหลังระงับลักษณะทางคลินิก (หลงผิดและประสาทหลอน) และลักษณะทางพยาธิวิทยา (พลากหลอดเลือดแดงแข็ง) ที่อยู่ในรายงานต้นฉบับของออกุสต์ เด. เขาใส่ โรคอัลไซเมอร์ หรือที่เครเพลินเรียกว่า ภาวะสมองเสื่อมก่อนวัยชรา (presenile dementia) เข้าเป็นชนิดย่อยของ ภาวะสมองเสื่อมในวัยชรา ใน ตำราจิตเวชศาสตร์ ฉบับพิมพ์ครั้งที่ 8 ซึ่งตีพิมพ์ปี 2453
สำหรับช่วงเวลาส่วนใหญ่ของคริสต์ศตวรรษที่ 20 การวินิจฉัยโรคอัลไซเมอร์สงวนไว้สำหรับปัจเจกอายุระหว่าง 45 ถึง 65 ปีซึ่งมีอาการภาวะสมองเสื่อม ศัพทวิทยาเปลี่ยนหลังปี 2520 เมื่อการประชุมเรื่อง AD สรุปว่าการแสดงออกทางคลินิกและพยาธิวิทยาของภาวะสมองเสื่อมก่อนวัยชราและวัยชราแทบไม่ต่างกัน แม้ผู้ประพันธ์เสริมว่าทั้งนี้ยังมีความเป็นไปได้ว่าอาจมีสาเหตุอย่างอื่น สุดท้ายทำให้การวินิจฉัยโรคอัลไซเมอร์ไม่ขึ้นกับอายุ มีการใช้คำว่า ภาวะสมองเสื่อมวัยชราชนิดอัลไซเมอร์ (SDAT) อยู่ช่วงหนึ่งเพื่ออธิบายโรคอัลไซเมอร์ในบุคคลอายุเกิน 65 ปี และคำว่า "โรคอัลไซเมอร์คลาสสิก" ใช้อธิบายบุคคลที่อายุน้อยกว่า 65 ปี สุดท้าย มีการเห็นชอบอย่าเป็นทาการให้ใช้โรคอัลไซเมอร์ในการตั้งชื่อทางการแพทย์เพื่ออธิบายบุคคลอายุเท่าใดก็ได้ที่มีรูปแบบอาการทั่วไป การดำเนินโรคและประสาทพยาธิวิทยาอันเป็นลักษณะของโรคอัลไซเมอร์
สังคมและวัฒนธรรม
ค่าใช้จ่ายทางสังคม
ภาวะสมองเสื่อม และโดยเฉพาะอย่างยิ่งโรคอัลไซเมอร์ อาจถือได้เป็นโรคที่เสียค่าใช้จ่ายสูงเป็นอันดับต้น ๆ สำหรับสังคมในทวีปยุโรปและสหรัฐ ขณะที่ค่าใช้จ่ายในประเทศอื่นอย่างอาร์เจนตินา และเกาหลีใต้ ก็สูงและกำลังเพิ่มขึ้นเช่นกัน ราคาของโรคอาจเพิ่มขึ้นจากสังคมที่มีผู้สูงอายุมากขึ้น และกลายเป็นปัญหาสังคมที่สำคัญ ค่าใช้จ่ายที่เกี่ยวข้องกับ AD มีทั้งค่าใช้จ่ายทางการแพทย์โดยตรง เช่น การบริบาลในสถานบริบาล ค่าใช้จ่ายที่มิใช่ทางการแพทย์โดยตรง เช่น การบริบาลเวลากลางวันในบ้าน (in-home day care) และค่าใช้จ่ายโดยอ้อม เช่น ผลิตภาพที่เสียไปของทั้งผู้ป่วยและผู้ดูแล มูลค่านี้แตกต่างกันไปตามการศึกษาต่าง ๆ แต่มูลค่าสำหรับภาวะสมองเสื่อมทั่วโลกคำนวณไว้ประมาณ 160,000 ล้านดอลลาร์สหรัฐ ส่วนมูลค่าของโรคอัลไซเมอร์ในสหรัฐอาจถึง 100,000 ล้านดอลลาร์สหรัฐต่อปี
ค่าใช้จ่ายสำหรับสังคมมีที่มาจากการบริบาลระยะยาวโดยวิชาชีพสาธารณสุขมากที่สุด โดยเฉพาะอย่างยิ่งการรับรักษาในสถานพยาบาลซึ่งคิดเป็นสองในสามของค่าใช้จ่ายทั้งหมดของสังคม ค่าใช้จ่ายของการอาศัยที่บ้านก็สูงมากเช่นกัน โดยเฉพาะเมื่อนำค่าใช้จ่ายโดยอ้อมสำหรับครอบครัว เช่น เวลาการให้การดูแลและรายได้ที่เสียไปของผู้ดูแล มาพิจารณาด้วย
ค่าใช้จ่ายเพิ่มขึ้นตามความรุนแรงของภาวะสมองเสื่อมและการมีพฤติกรรมเปลี่ยนแปลง และมีความสัมพันธ์กับเวลาที่ต้องให้การดูแลที่จำเป็นสำรับการบริบาลทางกายภาพ ฉะนั้น การรักษาใด ๆ ที่ชะลอการเสื่อมของการรู้ ชะลอการรับรักษาในสถานพยาบาล หรือลดชั่วโมงของผู้ดูแลจะมีประโยชน์ทางเศรษฐกิจ การประเมินการรักษาปัจจุบันทางเศรษฐกิจแสดงผลลัพธ์ทางบวก
ภาระของผู้ดูแล
ผู้ดูแลหลักมักเป็นคู่สมรสหรือญาติสนิท ทราบกันว่าโรคอัลไซเมอร์เป็นภาระใหญ่หวงต่อผู้ดูแลซึ่งมีทั้งแง่มุมทางสังคม จิตวิทยา กายภาพหรือเศรษฐกิจ ปกติผู้ป่วย AD และครอบครัวมักนิยมการบริบาลที่บ้าน ตัวเลือกนี้ยังชะลอหรือกำจัดความจำเป็นต้องได้รับากรบริบาลระดับที่เป็นวิชาชีพมากขึ้นและเสียค่าใช้จ่ายมากขึ้น กระนั้น ผู้อยู่อาศัยในสถานบริบาลสองในสามมีภาวะสมองเสื่อม
ผู้ดูแลผู้ป่วยสมองเสื่อมมีอัตราโรคทางกายและจิตใจสูง ปัจจัยที่สัมพันธ์กับปัญหาทางจิตสังคมที่เพิ่มขึ้นของผู้ดูแลหลัก ได้แก่ การมีผู้ป่วยที่บ้าน ผู้ดูแลเป็นคู่สมรส พฤติกรรมที่ต้องใช้ความพยายามอย่างยิ่งของผู้ป่วย เช่น โรคซึมเศร้า พฤติกรรมเปลี่ยน ประสาทหลอน ปัญหาการหลับหรือปัญหาการเดิน และการแยกตัวจากสังคม สำหรับปัญหาเศรษฐกิจ ผู้ดูแลครอบครัวมักต้องสละเวลางานเพื่อใช้เวลา 47 ชั่วโมงต่อสัปดาห์โดยเฉลี่ยกับผู้ป่วย AD ขณะที่มีค่าใช้จ่ายการบริบาลผู้ป่วยสูง ค่าใช้จ่ายโดยตรงและโดยอ้อมของการบริบาลผู้ป่วยโรคอัลไซเมอร์โดยเฉี่ยอยู่ระหว่าง 18,000 ถึง 77,500 ดอลลาร์สหรัฐต่อปีในสหรัฐ ขึ้นอยู่กับการศึกษา
การบำบัดทางความคิดและพฤติกรรมและการสอนยุทธศาสตร์การรับมือไม่ว่าแบบเดี่ยวหรือเป็นกลุ่มปรากฏว่ามีประสิทธิผลในการเพิ่มสุขภาพจิตของผู้ดูแล
สื่อ
มีการพรรณนา AD ในภาพยนตร์อย่าง ไอริส (ปี 2544) ซึ่งยึดบันทึกความทรงจำของไอริส เมอร์ด็อค ภรรยาของจอห์น เบย์ลีย์;เดอะโน้ตบุ๊ก (ปี 2547) ซึ่งอิงนวนิยายชื่อเดียวกันโดยนิโคลัส สปากส์ในปี 2539;เมมโมรีส์ออฟทูมอร์โรว์ (ปี 2549) ซึ่งอิงนวนิยายชื่อเดียวกันโดยฮิโรชิ โอกิวาระ;อะเวย์ฟรอมเฮอร์ (ปี 2549) ซึ่งอิงตามนิยายสั้น เดอะแบร์เคมโอเวอร์เดอะเมาน์เทน ของอลิซ มันโร;อลิซ...ไม่ลืม (Still Alice, ปี 2557) มีเนื้อหาว่าด้วยศาสตราจารย์มหาวิทยาลัยโคลัมเบียซึ่งป่วยเป็นโรคอัลไซเมอร์ระยะแรก โดยอิงตามนวนิยายชื่อเดียวกันเมื่อปี 2550 โดยลิซา จีโนวา สารคดีว่าด้วยโรคอัลไซเมอร์ ได้แก่ มัลคอล์มแอนด์บาร์บารา: อะเลิฟสตอรี (ปี 2542) และ มัลคอล์มแอนด์บาร์บารา: เลิฟส์แฟร์เวล (ปี 2550) ซึ่งมีมัลคอล์ม พอยต์ตันนำแสดงทั้งสองเรื่อง
ทิศทางการวิจัย
ยา
ในรอบทศวรรษปี 2545–2555 มีการประเมินสารประกอบ 244 ชนิดในการทดลองทางคลินิกระยะที่ 1, 2 และ 3 และมีสารประกอบชนิดเดียว (เมแมนทีน) ที่ได้รับอนุมัติจากคณะกรรมการอาหารและยาสหรัฐ โซเลนซูแมบ (solanezumab) และอะดูคานูแมบ (aducanumab) ไม่แสดงว่ามีประสิทธิภาพในผู้ที่มีอาการของโรคอัลไซเมอร์แล้ว
พื้นที่การวิจัยหนึ่งมุ่งเน้นการรักษาพยาธิภาพโรคพื้นเดิม การลดระดับบีตาแอมีลอยด์เป็นเป้าหมายทั่วไปของสารประกอบที่กำลังอยู่ระหว่างการสืบสวน (เช่น อะโปมอร์ฟีน) การบำบัดด้วยภูมิคุ้มกันหรือการให้วัคซีนสำหรับโปรตีนแอมีลอยด์เป็นวิธีการรักษาหนึ่งที่อยู่ระหว่างการศึกษา จะใช้การบำบัดแบบสันนิษฐาน (putative therapy) เพื่อรักษาผู้ที่ได้รับการวินิจฉัยแล้ว ซึ่งต่างจากการให้วัคซีนเพื่อป้องกัน ทั้งนี้ ตั้งอยู่บนมโนทัศน์ของการฝึกระบบภูมิคุ้มกันให้รับรู้ โจมตีและย้อนกลับซึ่งการสะสมแอมีอยด์เพื่อเปลี่ยนแปลงการดำเนินโรค ตัวอย่างของวัคซีนป้องกันที่กำลังอยู่ระหว่างการสืบสวนได้แก่ ACC-001 แม้มีการระงับการทดลองในปี 2551 สารที่คล้ายกันอีกสารหนึ่ง ได้แก่ บาพินิวซูแมบ (bapineuzumab) ซึ่งเป็นแอนติบอดีที่ได้รับการออกแบบมาให้เหมือนกับแอนติบอดีต่อแอมีลอยด์ที่เหนี่ยวนำตามธรรมชาติ อย่างไรก็ดี พบว่าสารภูมิคุ้มกันบำบัดก่อให้เกิดอาการไม่พึงประสงค์จากการใช้ยาที่น่ากังวลบางอย่าง เช่น ความผิดปกติของการสร้างภาพที่เกี่ยวข้องกับแอมีลอยด์ (amyloid-related imaging abnormalities) แนวทางการพัฒนายาอย่างอื่นคือสารที่ช่วยป้องกันระบบประสาท เช่น AL-108 และสารการลดอันตรกิริยาโลหะกับโปรตีน (metal-protein interaction attenuation agent) เช่น PBT2 ด้านโปรตีนรวมตัวที่ขัดขวางตัวรับทีเอ็นเอฟแอลฟา (TNFα receptor-blocking fusion protein) อีแทเนอร์เซปต์ (etanercept) ซึ่งให้ผลลัพธ์ที่ให้ความเชื่อมั่น
ในปี 2551 มีการทดลองทางคลินิกแยกกันสองการทดลองแสดงผลลัพธ์เชิงบวกในการเปลี่ยนการดำเนินโรคใน AD ขั้นเบาและปานกางด้วยเมทิลไทโอนิเนียมคลอไรด์ ซึ่งเป็นยายับยั้งการสะสมโปรตีนเทา และไดมีบอน สารต้านฮิสตามีน แต่การทดลองระยะที่ 3 ของไดมีบอนไม่มีผลเชิงบวกในจุดสิ้นสุดปฐมภูมิและทุติยภูมิ งานวิจัยเมทิลไทโอนิเนียมคลอไรด์แสดงว่าชีวปริมาณออกฤทธิ์ของเมทิลไทโอนิเนียมจากทางเดินอาหารได้รับผลกระทบจากการได้รับอาหารและความเป็นกรดของกระเพาะอาหาร ทำให้ขนาดยาแปรปรวนอย่างไม่คาดคิด สูตรที่มีการปรับให้เสถียรแล้วตัวใหม่ เช่น โปรดรัก LMTX อยู่ในการทดลองระยะที่ 3 (ในปี 2557)
การป้องกันเชิงพฤติกรรม
การวิจัยเรื่องผลของการทำสมาธิต่อการสงวนความจำและการทำหน้าที่เชิงการรู้ยังอยู่ในขั้นแรกเริ่ม บทปฏิทัศน์ในปี 2558 เสนอว่าการรักษาที่เน้นสติอาจป้องกันหรือชะลอการเกิดความบกพร่องทางการรู้เล็กน้อยและโรคอัลไซเมอร์ได้
การติดเชื้อและการส่งผ่าน
พบว่าไวรัสเริม HSV-1 อยู่ในบริเวณเดียวกับแอมีลอยด์พลาก ซึ่งมีการเสนอว่ามีความเป็นไปได้ที่สามารถรักษาหรือป้องกัน AD ด้วยยาต้านไวรัส การศึกษายาต้านไวรัสในการเพาะเซลล์ให้ผลลัพธ์ที่น่าพึงพอใจ
มีการอธิบายการติดเชื้อราของสมองผู้ป่วย AD มีการเสนอสมมติฐานโดยนักจุลชีววิทยา แอล. คาร์ราสโค เมื่อกลุ่มของเขาพบสหสัมพันธ์ทางสถิติระหว่างการติดเชื้อราทั่วร่างกับ AD งานวิจัยเพิ่มเติมเปิดเผยว่ามีการติดเชื้อราในบริเวณต่าง ๆ ของสมองผู้ป่วย AD แต่ไม่พบในปัจเจกควบคุม การติดเชื้อราอธิบายอาการที่สังเกตได้ในผู้ป่วย AD การดำเนินโรคอย่างช้าของ AD สมกับสภาพเรื้อรังของการติดเชื้อราทั่วกายบางชนิด ซึ่งอาจไม่มีอาการ ฉะนั้นจึงไม่ผิดสังเกตและไม่ได้รับการรักษา สมมติฐานเชื้อรายังเข้าได้กับสมมติฐาน AD อื่นที่มีอยู่แล้วอื่น เช่น สมมติฐานแอมีลอยด์ ซึ่งสามารถอธิบายได้ว่าเป็นการตอบสนองของระบบภูมิคุ้มกันต่อการติดเชื้อในระบบประสาทส่วนกลาง ดังที่ อาร์. มัวร์และ อาร์. แทนซีในแบบจำลอง AD ของหนูและหนอน
นอกจากนี้ กำลังมีการศึกษาการส่งผ่านระหว่างบุคคลที่เป็นไปได้ในผู้ป่วยหายาก เช่น ในผู้ป่วยโกรทฮอร์โมน
การสร้างภาพ
ในบรรดาเทคนิคการสร้างภาพทางการแพทย์ เครื่องถ่ายภาพรังสีชนิดแกมมาหลายระนาบ (single photon emission computed tomography) ดูเหมือนดีที่สุดในการแยกโรคอัลไซเมอร์จากภาวะสมองเสื่อมชนิดอื่น และมีการแสดงว่าระดับความแม่นยำสูงกว่าเมื่อเทียบกับการทดสอบทางจิตวิทยาและการวิเคราะห์ประวัติทางการแพทย์ ความก้าวหน้าดังกล่าวนำให้มีการเสนอให้เป็นเกณฑ์การวินิจฉัยใหม่
การถ่ายภาพรังสีระนาบด้วยการปล่อยโพซิตรอน (เพท) ด้วยพิตต์สเบิร์กคอมพาวน์บี (PiB) ยังใช้สืบสวนโรคได้อยู่ แต่เภสัชรังสีเพทสแกนคล้ายกัน ชื่อ ฟอร์เบตาพีร์ (florbetapir) ซึ่งมีฟลูออรีน-18 นิวไคลด์กัมมันตรังสีที่อยู่ได้นานกว่า เป็นเครื่องมือวินิจฉัยในโรคอัลไซเมอร์
การสร้างภาพแอมีลอยด์น่าจะใช้ร่วมกับมาร์กเกอร์อื่นมากกว่าใช้เป็นทางเลือกเดี่ยว ๆ เอ็มอาร์ไอเชิงปริมาตรสามารถตรวจจับการเปลี่ยนแปลงขนาดบริเวณต่าง ๆ ของสมองได้ การวัดบริเวณเห่านี้ว่าการฝ่อระหว่างการดำเนินโรคอัลไซเมอร์มีการแสดงผลลัพธ์ที่มีหวังว่าจะเป็นตัวบ่งชี้เพื่อวินิจฉัยในอนาคต และอาจมีราคาถูกกว่าวิธีสร้างภาพแบบอื่นที่กำลังศึกษาอยู่ในปัจจุบัน
ในปี 2554 คณะกรรมการองค์การอาหารและยาสหรัฐออกเสียงเป็นเอกฉันท์แนะนำการอนุมัติฟอร์เบตาพีร์ สารที่ใช้สร้างภาพดังกล่าวสามารถช่วยตรวจจับพลากสมองของโรคอัไซเมอร์ได้ ผลสแกนเป็นลบบ่งชี้ว่ามีพลากกระจัดกระจายหรือไม่มีพลาก ซึ่งไม่สอดคล้องกับการวินิจฉัย AD
การวินิจฉัย
มีการเน้นการวิจัยโรคอัลไซเมอร์ในด้านการวินิจฉัยโรคดังกล่าวก่อนเริ่มปรากฏอาการ มีการพัฒนาการทดสอบทางชีวเคมีหลายอย่างเพื่อให้ตรวจพบได้เร็วยิ่งขึ้น การทดสอบดังกล่าวบางอย่างเกี่ยวข้องกับการวิเคราะห์น้ำหล่อสมองไขสันหลังเพื่อหาบีตาแอมีลอยด์ ความเข้มข้นของโปรตีนเทารวม และโปรตีนเทา181พีที่เติมหมู่ฟอสเฟต การเจาะน้ำหล่อสมองไขสันหลังทำให้เจ็บปวดจึงควรเลี่ยงการเจาะซ้ำ ๆ การตรวจเลือดเพื่อหาไมโครอาร์เอ็นเอในระบบไหลเวียนและไบโอมาร์กเกอร์การอักเสบเป็นตัวบ่งชี้ทางเลือกที่อาจเป็นไปได้
เชิงอรรถ
บทอ่านเพิ่ม
- Alzheimer's Disease: Unraveling the Mystery. US Department of Health and Human Services, National Institute on Aging, NIH. 2008. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 8 January 2012.
- Can Alzheimer's Disease Be Prevented? (PDF). US Department of Health and Human Services, National Institute on Aging, NIH. 2009. คลังข้อมูลเก่าเก็บจากแหล่งเดิม (PDF)เมื่อ 2 May 2013.
- Caring for a Person with Alzheimer's Disease: Your Easy-to-Use Guide from the National Institute on Aging. US Department of Health and Human Services, National Institute on Aging, NIH. 2009. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 8 January 2012.
- Russell D, Barston S, White M (19 December 2007). "Alzheimer's Behavior Management: Learn to Manage Common Behavior Problems". helpguide.org. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 23 February 2008. สืบค้นเมื่อ 29 February 2008.
- Irvine K, Laws KR, Gale TM, Kondel TK (2012). "Greater cognitive deterioration in women than men with Alzheimer's disease: a meta analysis". Journal of Clinical and Experimental Neuropsychology (Meta-analysis). 34 (9): 989–98. doi:10.1080/13803395.2012.712676. PMID 22913619.
แหล่งข้อมูลอื่น
- โรคอัลไซเมอร์ ที่เว็บไซต์ Curlie
|
คอมมอนส์ มีภาพและสื่อเกี่ยวกับ: โรคอัลไซเมอร์ |
| การจำแนกโรค | |
|---|---|
| ทรัพยากรภายนอก |
|